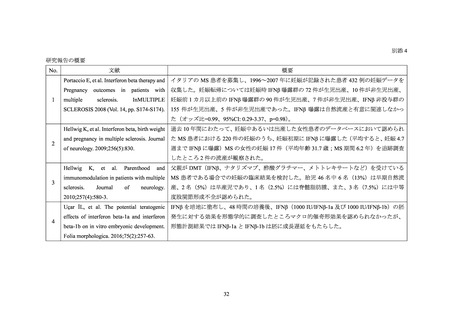
よむ、つかう、まなぶ。
資料2-2 調査結果報告書 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
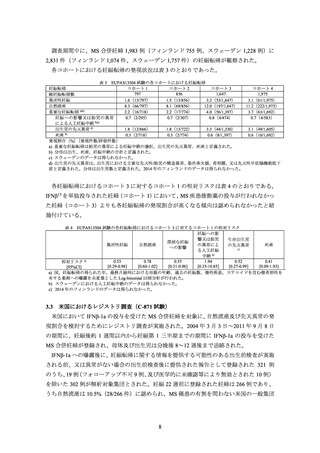
2.5.2
IFNβ-1b
Contraindication の項に妊婦又は妊娠している可能性のある女性は設定されていない。
Pregnant Women の項に以下の内容が記載されている。
妊婦を対象とした、臨床試験は実施されていない。必要性が明らかな場合以外は妊娠中
の投与を避けるべきである。
欧州の研究において、Interferon beta による治療を受けた MS 合併妊婦における有害事
象の割合は、既報の公表文献と同様であった。
北欧レジストリ調査(3.2 参照)では、Interferon beta の投与後における先天異常のリス
クの増加は示されていない。しかし、Interferon beta の妊婦への使用が禁忌であった時
期にデータが収集され、妊娠の判明後には Interferon beta による治療が中断されたこと
から、Interferon beta の妊娠第 1 三半期での曝露期間は明確ではない。妊娠第 2 及び第
3 三半期において、母体又は胎児に及ぼす健康上の影響に関する投与経験は非常に限ら
れている。
アカゲザルにおいて 0.42 mg(13.3 MIU)/kg/日までの投与で催奇形性はないが、0.028
~0.42 mg/kg/日(ヒト体表面積換算時における推奨用量の 2.8~40 倍)において用量依
存的に流産促進作用がみられた。非臨床試験における結果がヒトに外挿できるかは明
らかではない。
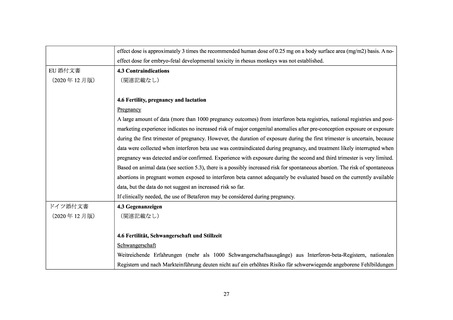
2.6 オーストラリア添付文書
2.6.1
IFNβ-1a
Contraindications の項に妊婦又は妊娠を予定している女性が設定されている。また、Fertility,
Pregnancy and Lactation の項に以下の内容が記載されている。
IFNβ-1a はアカゲザルにおいて 50 µg/kg まで催奇形性を示さない。50 µg/kg では流産が
認められたが 1.25 µg/kg では認められなかった。
妊娠中に IFNβ-1a を使用したときの情報は限られている。米国レジストリ調査(3.3 参
照)では MS 合併妊婦 302 人のうち多くは妊娠第 1 三半期(平均曝露期間 5.2 週)に曝
露があった。IFNβ-1a の曝露は自然流産率を増加させず、先天異常の発現傾向に一般集
団との違いはみられなかった。調査に限界があること、及び MS 患者における対照群の
データが存在しないことから、調査結果の重要性は明確ではない。
妊娠中に IFNβ-1a による治療を開始することは禁忌である。妊娠する可能性のある女性
は、IFNβ-1a による治療中には適切な方法で避妊するべきである。患者が妊娠する又は
妊娠を予定している場合は、胎児に対する潜在的な危険性について情報提供を行うと
ともに、有益性が胎児への危険性を上回らなければ治療を中止するよう勧めるべきで
ある。
2.6.2
IFNβ-1b
Contraindication の項に妊婦又は妊娠している可能性のある女性は設定されていない。
5
IFNβ-1b
Contraindication の項に妊婦又は妊娠している可能性のある女性は設定されていない。
Pregnant Women の項に以下の内容が記載されている。
妊婦を対象とした、臨床試験は実施されていない。必要性が明らかな場合以外は妊娠中
の投与を避けるべきである。
欧州の研究において、Interferon beta による治療を受けた MS 合併妊婦における有害事
象の割合は、既報の公表文献と同様であった。
北欧レジストリ調査(3.2 参照)では、Interferon beta の投与後における先天異常のリス
クの増加は示されていない。しかし、Interferon beta の妊婦への使用が禁忌であった時
期にデータが収集され、妊娠の判明後には Interferon beta による治療が中断されたこと
から、Interferon beta の妊娠第 1 三半期での曝露期間は明確ではない。妊娠第 2 及び第
3 三半期において、母体又は胎児に及ぼす健康上の影響に関する投与経験は非常に限ら
れている。
アカゲザルにおいて 0.42 mg(13.3 MIU)/kg/日までの投与で催奇形性はないが、0.028
~0.42 mg/kg/日(ヒト体表面積換算時における推奨用量の 2.8~40 倍)において用量依
存的に流産促進作用がみられた。非臨床試験における結果がヒトに外挿できるかは明
らかではない。
2.6 オーストラリア添付文書
2.6.1
IFNβ-1a
Contraindications の項に妊婦又は妊娠を予定している女性が設定されている。また、Fertility,
Pregnancy and Lactation の項に以下の内容が記載されている。
IFNβ-1a はアカゲザルにおいて 50 µg/kg まで催奇形性を示さない。50 µg/kg では流産が
認められたが 1.25 µg/kg では認められなかった。
妊娠中に IFNβ-1a を使用したときの情報は限られている。米国レジストリ調査(3.3 参
照)では MS 合併妊婦 302 人のうち多くは妊娠第 1 三半期(平均曝露期間 5.2 週)に曝
露があった。IFNβ-1a の曝露は自然流産率を増加させず、先天異常の発現傾向に一般集
団との違いはみられなかった。調査に限界があること、及び MS 患者における対照群の
データが存在しないことから、調査結果の重要性は明確ではない。
妊娠中に IFNβ-1a による治療を開始することは禁忌である。妊娠する可能性のある女性
は、IFNβ-1a による治療中には適切な方法で避妊するべきである。患者が妊娠する又は
妊娠を予定している場合は、胎児に対する潜在的な危険性について情報提供を行うと
ともに、有益性が胎児への危険性を上回らなければ治療を中止するよう勧めるべきで
ある。
2.6.2
IFNβ-1b
Contraindication の項に妊婦又は妊娠している可能性のある女性は設定されていない。
5