よむ、つかう、まなぶ。
資料2-2 調査結果報告書 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
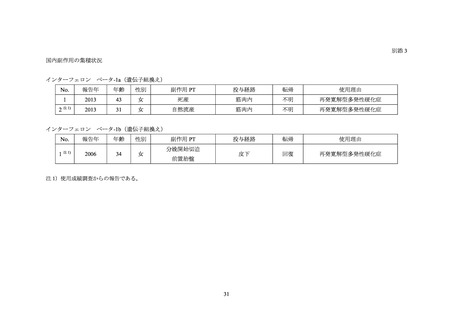
IFNβ-1a の使用成績調査では 1,510 例の症例が収集され、MS 合併妊婦 17 例中、流産 1 件、
人工流産 1 件が報告された(平成 30 年 2 月 1 日
ネックス筋注 30µg ペン
アボネックス筋注用シリンジ 30µg、アボ
再審査報告書)。また、IFNβ-1b の使用成績調査では 1,371 例の症
例が収集され、MS 合併妊婦 14 例中、前置胎盤による帝王切開 1 件が報告された(平成 25
年 5 月 14 日
ベタフェロン皮下注用 960 万国際単位
再審査報告書)
。なお、国内副作用
報告と使用成績調査の報告には重複がある。
7. 研究報告及び外国措置報告
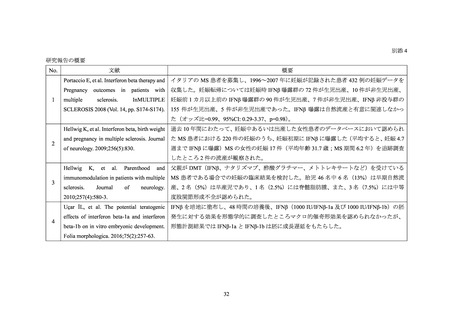
2021 年 8 月 31 日までに報告された、妊婦に IFNβ-1a 又は IFNβ-1b を投与した場合の先天
異常に関連するの研究報告は 4 報であった(別添 4)。また、2021 年 8 月 31 日までに報告さ
れた、妊婦に IFNβ-1a 又は IFNβ-1b を投与した場合の先天異常に関連するの外国措置報告は
なかった。
8. 調査の結果を踏まえた機構の判断について
機構は、以下の理由から IFNβ の使用上の注意における「2.禁忌」の「妊婦又は妊娠して
いる可能性のある女性」を削除し、妊婦又は妊娠している可能性のある女性には治療上の有
益性が危険性を上回ると判断される場合にのみ投与とすることは可能と考える。
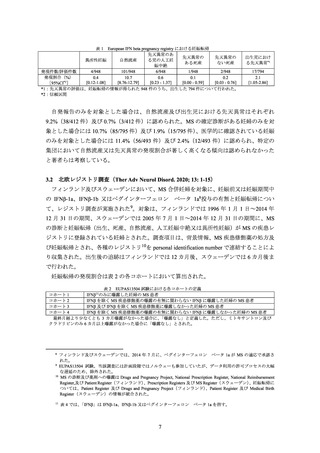
IFNβ-1b、IFNβ-1a のサル生殖発生毒性試験では、胎児死亡又は流産が認められたが、以
下の点を考慮すると、現時点の考え方からは、当該試験に基づき、妊婦又は妊娠してい
る可能性のある女性に対しての投与を一律に禁忌とする必要性は高くないと考えられ
ること。
IFNβ-1b では、多発性硬化症患者に 1.6 及び 8 MIU を単回皮下投与したときの血清
中 IFN 濃度はほとんどの測定時点で定量下限未満であったこと31から、ヒトとサル
における曝露量を比較することはできないが、胎児死亡及び流産はヒト臨床用量
の 119 倍(体表面積換算で 40 倍)では認められず、200 倍(体表面積換算で 67 倍)
以上の高用量で認められたこと32。
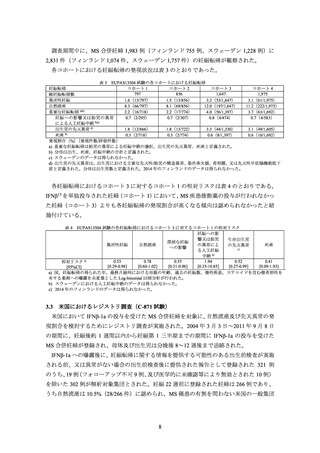
IFNβ-1a では、生殖発生毒性試験において曝露量は測定されていないが、非臨床薬
物動態試験においてサルに 10 MIU/kg を単回皮下投与したときの AUC に基づく
と、サル生殖発生毒性試験で流産が認められた 10 MIU/kg 隔日皮下投与群の曝露
量は、健康成人に 31.5μg を単回筋肉内投与したときの曝露量(AUC 384 IU・hr/mL)
の 83~163 倍に相当すると考えられること。なお、流産の認められなかった 0.25
MIU/kg 隔日皮下投与群の曝露量を推定できるデータはないが、ヒト臨床用量の 5.8
倍(体表面積換算で 1.9 倍)に相当する。
31
32
ベタフェロン審査報告書
IFNβ-1b の製造販売承認時に実施されたアカゲザルの器官形成期投与試験において、妊娠 20~70 日に IFNβ-1b を
皮下投与したとき、13.4 百万国際単位/kg/日(MIU/kg/日)以上の投与群で流産又は胎児死亡率の増加が認められ、
母動物の生殖能及び胎児に対する無毒性量は 8 MIU/kg/日とされた。8 及び 13.4MIU/kg/日は、それぞれ、体表面
積換算で、ヒトの臨床用量である約 5.4µg/kg を投与したときの約 40 倍及び 67 倍に相当する。
17
人工流産 1 件が報告された(平成 30 年 2 月 1 日
ネックス筋注 30µg ペン
アボネックス筋注用シリンジ 30µg、アボ
再審査報告書)。また、IFNβ-1b の使用成績調査では 1,371 例の症
例が収集され、MS 合併妊婦 14 例中、前置胎盤による帝王切開 1 件が報告された(平成 25
年 5 月 14 日
ベタフェロン皮下注用 960 万国際単位
再審査報告書)
。なお、国内副作用
報告と使用成績調査の報告には重複がある。
7. 研究報告及び外国措置報告
2021 年 8 月 31 日までに報告された、妊婦に IFNβ-1a 又は IFNβ-1b を投与した場合の先天
異常に関連するの研究報告は 4 報であった(別添 4)。また、2021 年 8 月 31 日までに報告さ
れた、妊婦に IFNβ-1a 又は IFNβ-1b を投与した場合の先天異常に関連するの外国措置報告は
なかった。
8. 調査の結果を踏まえた機構の判断について
機構は、以下の理由から IFNβ の使用上の注意における「2.禁忌」の「妊婦又は妊娠して
いる可能性のある女性」を削除し、妊婦又は妊娠している可能性のある女性には治療上の有
益性が危険性を上回ると判断される場合にのみ投与とすることは可能と考える。
IFNβ-1b、IFNβ-1a のサル生殖発生毒性試験では、胎児死亡又は流産が認められたが、以
下の点を考慮すると、現時点の考え方からは、当該試験に基づき、妊婦又は妊娠してい
る可能性のある女性に対しての投与を一律に禁忌とする必要性は高くないと考えられ
ること。
IFNβ-1b では、多発性硬化症患者に 1.6 及び 8 MIU を単回皮下投与したときの血清
中 IFN 濃度はほとんどの測定時点で定量下限未満であったこと31から、ヒトとサル
における曝露量を比較することはできないが、胎児死亡及び流産はヒト臨床用量
の 119 倍(体表面積換算で 40 倍)では認められず、200 倍(体表面積換算で 67 倍)
以上の高用量で認められたこと32。
IFNβ-1a では、生殖発生毒性試験において曝露量は測定されていないが、非臨床薬
物動態試験においてサルに 10 MIU/kg を単回皮下投与したときの AUC に基づく
と、サル生殖発生毒性試験で流産が認められた 10 MIU/kg 隔日皮下投与群の曝露
量は、健康成人に 31.5μg を単回筋肉内投与したときの曝露量(AUC 384 IU・hr/mL)
の 83~163 倍に相当すると考えられること。なお、流産の認められなかった 0.25
MIU/kg 隔日皮下投与群の曝露量を推定できるデータはないが、ヒト臨床用量の 5.8
倍(体表面積換算で 1.9 倍)に相当する。
31
32
ベタフェロン審査報告書
IFNβ-1b の製造販売承認時に実施されたアカゲザルの器官形成期投与試験において、妊娠 20~70 日に IFNβ-1b を
皮下投与したとき、13.4 百万国際単位/kg/日(MIU/kg/日)以上の投与群で流産又は胎児死亡率の増加が認められ、
母動物の生殖能及び胎児に対する無毒性量は 8 MIU/kg/日とされた。8 及び 13.4MIU/kg/日は、それぞれ、体表面
積換算で、ヒトの臨床用量である約 5.4µg/kg を投与したときの約 40 倍及び 67 倍に相当する。
17