よむ、つかう、まなぶ。
資料2-2 調査結果報告書 (1 ページ)
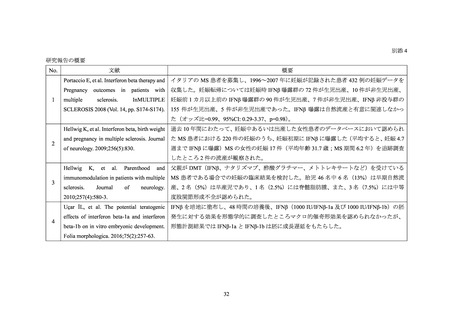
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和4年3月22日
令和3年度医薬品等安全対策調査会
別紙
資料2-2
調査結果報告書
令和 4 年 3 月 2 日
独立行政法人
医薬品医療機器総合機構
I. 品目の概要
[一
[販
般
売
名]
名]
①インターフェロン
ベータ-1a(遺伝子組換え)
②インターフェロン
ベータ-1b(遺伝子組換え)
①アボネックス筋注 30 μg ペン、同筋注用シリンジ 30 μg
②ベタフェロン皮下注用 960 万国際単位
[承認取得者]
①バイオジェン・ジャパン株式会社
②バイエル薬品株式会社
[効能・効果]
①多発性硬化症の再発予防
②多発性硬化症の再発予防及び進行抑制
[用法・用量] ①通常、成人にはインターフェロン
ベータ‐1a(遺伝子組換え)として
1 回 30 μg を週一回筋肉内投与する。
②通常、成人には 800 万国際単位を皮下に隔日投与する。
[調査担当部]
医薬品安全対策第一部
II. 今回の調査の経緯
インターフェロン
ベータ-1a(遺伝子組換え)
(以下、「IFNβ-1a」)は、1996 年 5 月に米
国で承認されて以降、EU 等 85 の国又は地域で承認されている。また、インターフェロン
ベータ-1b(遺伝子組換え)(以下、
「IFNβ-1b」)は、1993 年 7 月に米国で承認されて以降、
EU 等 92 の国又は地域で承認されている。
本邦では、IFNβ-1a は 2006 年 7 月に「多発性硬化症の再発予防」の効能又は効果で、IFNβ1b は 2000 年 9 月に「多発性硬化症の再発予防及び進行抑制」の効能又は効果で製造販売承
認されている。
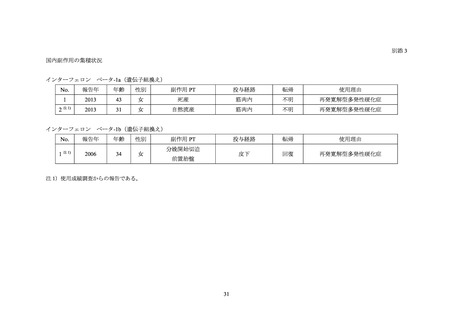
本邦の現行の IFNβ-1a 及び IFNβ-1b(以下、
「IFNβ」)の電子化された添付文書(以下、
「電
子添文」)には製造販売承認審査時より禁忌の項に妊婦又は妊娠している可能性のある女性
が設定されている。
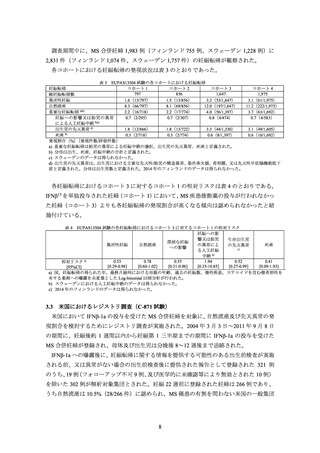
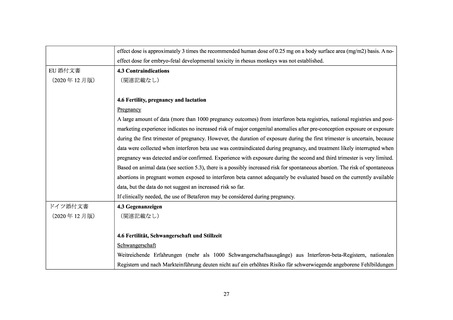
EU では、初回承認時(IFNβ-1a:1997 年 3 月、IFNβ-1b:1995 年 11 月)時点では、妊婦
又は妊娠している可能性のある女性に対する投与は禁忌であった。2009~2017 年に、欧州
26 カ国及び北欧(フィンランド及びスウェーデン)でそれぞれ実施された、IFNβ が投与さ
れた妊婦を対象としたレジストリ調査(以下、それぞれ「欧州レジストリ調査」及び「北欧
レジストリ調査」)に基づき(3.1、3.2 参照)、EU では 2019 年に妊婦又は妊娠している可能
性のある女性に対する投与の禁忌が解除された。なお、米国では、初回承認時(IFNβ-1a:
令和3年度医薬品等安全対策調査会
別紙
資料2-2
調査結果報告書
令和 4 年 3 月 2 日
独立行政法人
医薬品医療機器総合機構
I. 品目の概要
[一
[販
般
売
名]
名]
①インターフェロン
ベータ-1a(遺伝子組換え)
②インターフェロン
ベータ-1b(遺伝子組換え)
①アボネックス筋注 30 μg ペン、同筋注用シリンジ 30 μg
②ベタフェロン皮下注用 960 万国際単位
[承認取得者]
①バイオジェン・ジャパン株式会社
②バイエル薬品株式会社
[効能・効果]
①多発性硬化症の再発予防
②多発性硬化症の再発予防及び進行抑制
[用法・用量] ①通常、成人にはインターフェロン
ベータ‐1a(遺伝子組換え)として
1 回 30 μg を週一回筋肉内投与する。
②通常、成人には 800 万国際単位を皮下に隔日投与する。
[調査担当部]
医薬品安全対策第一部
II. 今回の調査の経緯
インターフェロン
ベータ-1a(遺伝子組換え)
(以下、「IFNβ-1a」)は、1996 年 5 月に米
国で承認されて以降、EU 等 85 の国又は地域で承認されている。また、インターフェロン
ベータ-1b(遺伝子組換え)(以下、
「IFNβ-1b」)は、1993 年 7 月に米国で承認されて以降、
EU 等 92 の国又は地域で承認されている。
本邦では、IFNβ-1a は 2006 年 7 月に「多発性硬化症の再発予防」の効能又は効果で、IFNβ1b は 2000 年 9 月に「多発性硬化症の再発予防及び進行抑制」の効能又は効果で製造販売承
認されている。
本邦の現行の IFNβ-1a 及び IFNβ-1b(以下、
「IFNβ」)の電子化された添付文書(以下、
「電
子添文」)には製造販売承認審査時より禁忌の項に妊婦又は妊娠している可能性のある女性
が設定されている。
EU では、初回承認時(IFNβ-1a:1997 年 3 月、IFNβ-1b:1995 年 11 月)時点では、妊婦
又は妊娠している可能性のある女性に対する投与は禁忌であった。2009~2017 年に、欧州
26 カ国及び北欧(フィンランド及びスウェーデン)でそれぞれ実施された、IFNβ が投与さ
れた妊婦を対象としたレジストリ調査(以下、それぞれ「欧州レジストリ調査」及び「北欧
レジストリ調査」)に基づき(3.1、3.2 参照)、EU では 2019 年に妊婦又は妊娠している可能
性のある女性に対する投与の禁忌が解除された。なお、米国では、初回承認時(IFNβ-1a: