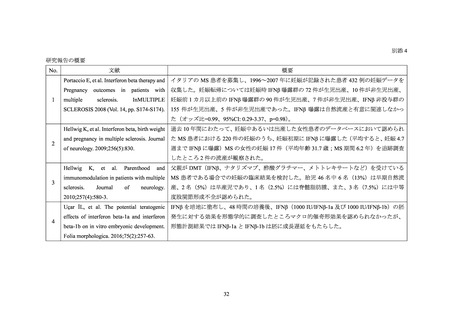
よむ、つかう、まなぶ。
資料2-2 調査結果報告書 (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24579.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和3年度第31回 3/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
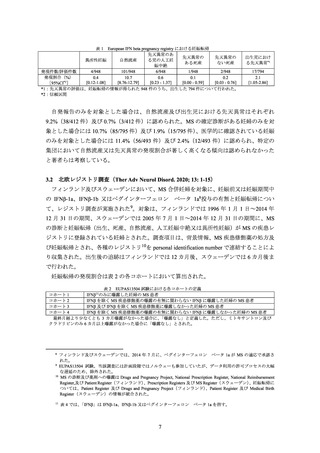
1996 年 5 月、IFNβ-1b:1993 年 7 月)より、禁忌の項に妊婦又は妊娠している可能性のある
女性が設定されていない。
今般、IFNβ-1a の製造販売承認取得者より、IFNβ-1a 又は IFNβ-1b のレジストリ調査(3.1
~3.3 参照)の結果を主な根拠として、IFNβ-1a の使用上の注意の「禁忌」の項に記載されて
いる妊婦又は妊娠している可能性のある女性に関する記載を削除し、妊婦又は妊娠してい
る可能性のある女性への使用を治療上の有益性が危険性を上回る場合にのみ投与すること
に変更する旨の相談が申し込まれた。また、IFNβ-1b の製造販売承認取得者より、海外のレ
ジストリ調査及び市販後調査成績の概要を記載する旨の相談が申し込まれた。これらの相
談が申し込まれたことを受け、独立行政法人医薬品医療機器総合機構(以下、
「機構」)は本
調査を行うに至った。
なお、機構は、調査において専門協議を実施しており、本専門協議の専門委員は、本品目
についての専門委員からの申し出等に基づき、
「医薬品医療機器総合機構における専門協議
等の実施に関する達」
(平成 20 年 12 月 25 日付け
20 達第 8 号)の規定により、指名した。
III. 機構における調査の概略
1. 本邦における製造販売承認時までの状況
IFNβ-1b の製造販売承認時には、IFNβ-1b の妊婦又は妊娠している可能性のある女性に対
する投与が禁忌に設定され、使用上の注意の「妊婦」の項に、「動物試験(サル)において
本剤の高用量の投与で胎児死亡・流産が認められたとの報告がある」と理由が記載された。
(ベタフェロン皮下注用 960 万国際単位
電子添文)。
同様に、IFNβ-1a の製造販売承認時に、IFNβ-1a の妊婦又は妊娠している可能性のある女
性に対する投与が禁忌に設定され、使用上の注意の「妊婦」の項に、
「動物試験(サル)に
おいて本剤の高用量の投与で流産が認められたとの報告がある」と理由が記載された。(ア
ボネックス筋注 30 µg ペン/筋注用シリンジ 30 μg 電子添文)
。
2. 海外の添付文書の記載状況
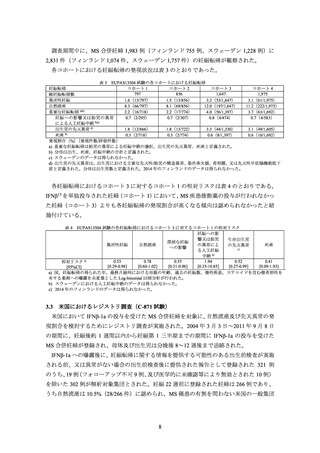
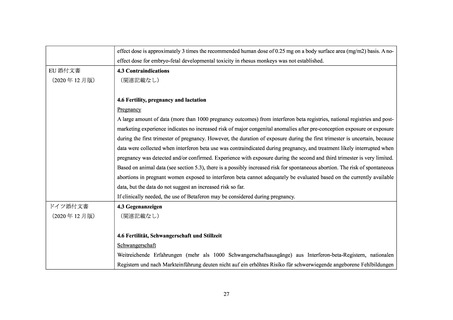
米国、EU(英国を含む)
、ドイツ、フランス、カナダ及びオーストラリアにおける IFNβ1a 及び IFNβ-1b の添付文書について、妊婦又は妊娠している可能性のある女性への投与に
関する記載状況は下記のとおりであった(別添 1、別添 2)。
2.1 米国添付文書
2.1.1
IFNβ-1a
承認当初より、Contraindications の項に妊婦又は妊娠している可能性のある女性は設定さ
れていない。Pregnancy の項には以下の内容が記載されている。
観察研究の大部分からは、妊娠初期の Interferon beta1の曝露と重大な先天異常のリスク
の増加との関連を認めなかった。
1
2~4 項については、原文にて「interferon beta」や「interferon β」と記載のあるものは「Interferon beta」と記載した。
2
女性が設定されていない。
今般、IFNβ-1a の製造販売承認取得者より、IFNβ-1a 又は IFNβ-1b のレジストリ調査(3.1
~3.3 参照)の結果を主な根拠として、IFNβ-1a の使用上の注意の「禁忌」の項に記載されて
いる妊婦又は妊娠している可能性のある女性に関する記載を削除し、妊婦又は妊娠してい
る可能性のある女性への使用を治療上の有益性が危険性を上回る場合にのみ投与すること
に変更する旨の相談が申し込まれた。また、IFNβ-1b の製造販売承認取得者より、海外のレ
ジストリ調査及び市販後調査成績の概要を記載する旨の相談が申し込まれた。これらの相
談が申し込まれたことを受け、独立行政法人医薬品医療機器総合機構(以下、
「機構」)は本
調査を行うに至った。
なお、機構は、調査において専門協議を実施しており、本専門協議の専門委員は、本品目
についての専門委員からの申し出等に基づき、
「医薬品医療機器総合機構における専門協議
等の実施に関する達」
(平成 20 年 12 月 25 日付け
20 達第 8 号)の規定により、指名した。
III. 機構における調査の概略
1. 本邦における製造販売承認時までの状況
IFNβ-1b の製造販売承認時には、IFNβ-1b の妊婦又は妊娠している可能性のある女性に対
する投与が禁忌に設定され、使用上の注意の「妊婦」の項に、「動物試験(サル)において
本剤の高用量の投与で胎児死亡・流産が認められたとの報告がある」と理由が記載された。
(ベタフェロン皮下注用 960 万国際単位
電子添文)。
同様に、IFNβ-1a の製造販売承認時に、IFNβ-1a の妊婦又は妊娠している可能性のある女
性に対する投与が禁忌に設定され、使用上の注意の「妊婦」の項に、
「動物試験(サル)に
おいて本剤の高用量の投与で流産が認められたとの報告がある」と理由が記載された。(ア
ボネックス筋注 30 µg ペン/筋注用シリンジ 30 μg 電子添文)
。
2. 海外の添付文書の記載状況
米国、EU(英国を含む)
、ドイツ、フランス、カナダ及びオーストラリアにおける IFNβ1a 及び IFNβ-1b の添付文書について、妊婦又は妊娠している可能性のある女性への投与に
関する記載状況は下記のとおりであった(別添 1、別添 2)。
2.1 米国添付文書
2.1.1
IFNβ-1a
承認当初より、Contraindications の項に妊婦又は妊娠している可能性のある女性は設定さ
れていない。Pregnancy の項には以下の内容が記載されている。
観察研究の大部分からは、妊娠初期の Interferon beta1の曝露と重大な先天異常のリスク
の増加との関連を認めなかった。
1
2~4 項については、原文にて「interferon beta」や「interferon β」と記載のあるものは「Interferon beta」と記載した。
2