よむ、つかう、まなぶ。
資料1-3 指摘事項に対する回答 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_36522.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第156回 12/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
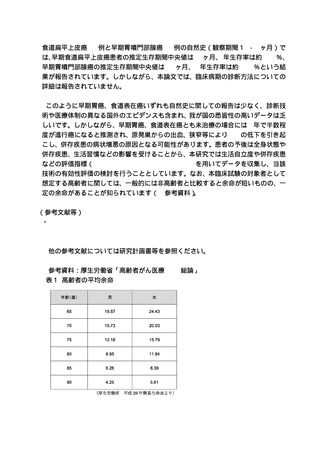
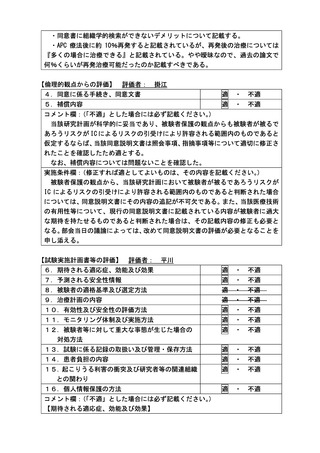
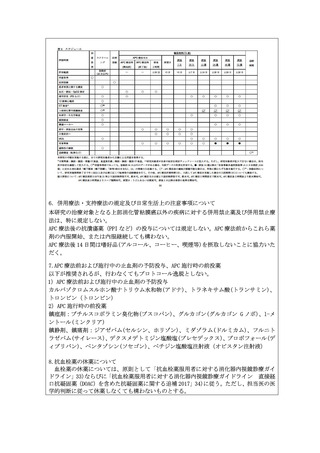
2.本技術の有用性を判断するためには、主要評価項目を局所の完全奏効割合ではなく
生命予後の評価とするべきであると考えます。主要評価項目を生存率ではなく術後 12
週の完全奏効割合としたことについて合理的に説明してください。
また、主要評価項目を術後 12 週の完全奏効割合とした場合に、根治性の評価として
組織学的な評価が必須ではないか検討してください。
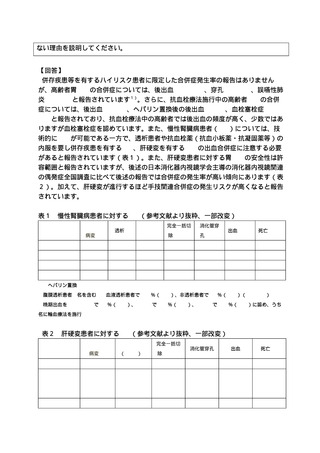
【回答】
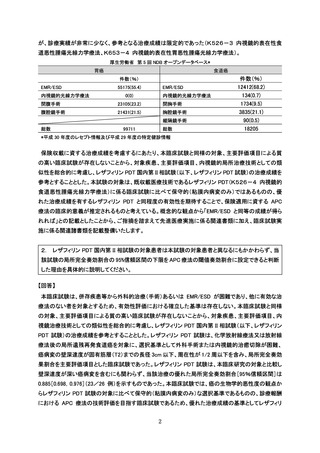
○ 主要評価項目および根治性の評価について
本臨床試験の評価項目については、研究計画書 10.1 に挙げた事由の他、研究対象者
は異なりますが、類似医療技術の薬事評価(保険収載)を行なったレザフィリン PDT の
国内Ⅱ相治験(研究計画書 17.2)及び「抗悪性腫瘍薬の臨床評価方法に関するガイド
ライン(厚生労働省医薬・生活衛生局医薬品審査管理課長通知、以下「ガイドライン」
と略記)」を参考としました。本臨床試験はガイドラインにおける第 II 相試験に相当
するものであり、臨床的意義のある治療効果として、通常、腫瘍縮小効果が用いられる
ことを踏まえ、主要評価項目を局所完全奏効割合としました。
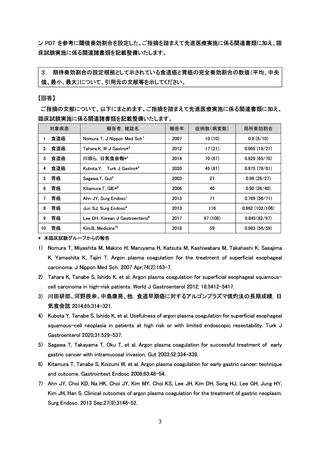
当該ガイドラインにおいて、全生存期間等、時間に依存する指標を主要評価項目とし
て有効性を評価する場合、対照を置くランダム化比較試験の実施が推奨されています。
しかしながら、研究計画書 6.1 に示すように本臨床研究の対象となる患者数が限定的
であり、APC 療法と無治療経過観察をランダム化比較する臨床研究の実施は非常に困難
であると考えます。
本臨床試験の対象は多様な疾病背景を持つ患者集団であり、適切なヒストリカルコン
トロールデータは存在しないものの、本臨床試験実施期間終了後も追跡調査の継続を
計画し、全生存割合(3 年生存率、5 年生存率)等について評価することとします。
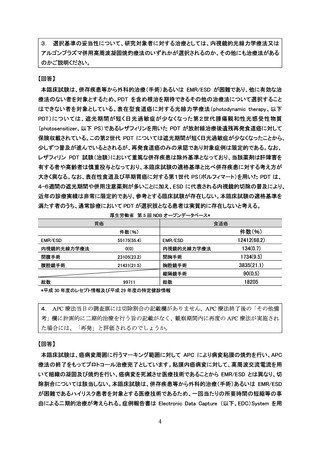
当該医療技術の組織学的評価については、抗血栓薬の投与を必要とする基礎疾患を有
し休薬ができない者、透析や肝硬変患者、血小板が減少しているが 3 万/µL 以上を有す
る者といった生検後出血の相対的リスクが高い集団が含まれることから、研究対象患
者の安全性の担保及び内視鏡観察による正診率を考慮し APC 療法後の生検について定
めました。しかしながら、抗血栓薬と生検後の出血に関する大規模な無作為化試験等の
エビデンスが十分でないこと、有害事象の発症リスクと組織診断の重要性を考量し、主
要評価項目である局所遺残再発に関する存在診断の蓋然性担保のため、原則、APC 療法
後の生検を実施いたします。
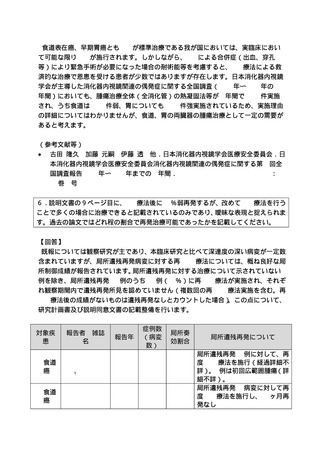
○保険収載を目的とする当該臨床試験の評価項目について
本医療技術の保険収載が検討される場合には、本臨床試験の評価項目として定める
局所奏効割合、全生存割合、安全性等を含め、その有効性については総合的に評価さ
れるものと考えています。当該臨床試験の主要評価項目である局所奏効割合について
は臨床的意義のある治療効果のサロゲート指標として、一定の意義が認められていま
す。当該技術の有効性として、局所奏効割合が検証された上で、全生存割合等のデー
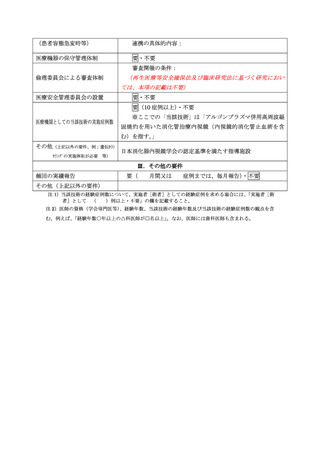
生命予後の評価とするべきであると考えます。主要評価項目を生存率ではなく術後 12
週の完全奏効割合としたことについて合理的に説明してください。
また、主要評価項目を術後 12 週の完全奏効割合とした場合に、根治性の評価として
組織学的な評価が必須ではないか検討してください。
【回答】
○ 主要評価項目および根治性の評価について
本臨床試験の評価項目については、研究計画書 10.1 に挙げた事由の他、研究対象者
は異なりますが、類似医療技術の薬事評価(保険収載)を行なったレザフィリン PDT の
国内Ⅱ相治験(研究計画書 17.2)及び「抗悪性腫瘍薬の臨床評価方法に関するガイド
ライン(厚生労働省医薬・生活衛生局医薬品審査管理課長通知、以下「ガイドライン」
と略記)」を参考としました。本臨床試験はガイドラインにおける第 II 相試験に相当
するものであり、臨床的意義のある治療効果として、通常、腫瘍縮小効果が用いられる
ことを踏まえ、主要評価項目を局所完全奏効割合としました。
当該ガイドラインにおいて、全生存期間等、時間に依存する指標を主要評価項目とし
て有効性を評価する場合、対照を置くランダム化比較試験の実施が推奨されています。
しかしながら、研究計画書 6.1 に示すように本臨床研究の対象となる患者数が限定的
であり、APC 療法と無治療経過観察をランダム化比較する臨床研究の実施は非常に困難
であると考えます。
本臨床試験の対象は多様な疾病背景を持つ患者集団であり、適切なヒストリカルコン
トロールデータは存在しないものの、本臨床試験実施期間終了後も追跡調査の継続を
計画し、全生存割合(3 年生存率、5 年生存率)等について評価することとします。
当該医療技術の組織学的評価については、抗血栓薬の投与を必要とする基礎疾患を有
し休薬ができない者、透析や肝硬変患者、血小板が減少しているが 3 万/µL 以上を有す
る者といった生検後出血の相対的リスクが高い集団が含まれることから、研究対象患
者の安全性の担保及び内視鏡観察による正診率を考慮し APC 療法後の生検について定
めました。しかしながら、抗血栓薬と生検後の出血に関する大規模な無作為化試験等の
エビデンスが十分でないこと、有害事象の発症リスクと組織診断の重要性を考量し、主
要評価項目である局所遺残再発に関する存在診断の蓋然性担保のため、原則、APC 療法
後の生検を実施いたします。
○保険収載を目的とする当該臨床試験の評価項目について
本医療技術の保険収載が検討される場合には、本臨床試験の評価項目として定める
局所奏効割合、全生存割合、安全性等を含め、その有効性については総合的に評価さ
れるものと考えています。当該臨床試験の主要評価項目である局所奏効割合について
は臨床的意義のある治療効果のサロゲート指標として、一定の意義が認められていま
す。当該技術の有効性として、局所奏効割合が検証された上で、全生存割合等のデー