よむ、つかう、まなぶ。
資料1.緊急時の薬事承認の在り方. (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_22502.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和3度第2回 12/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
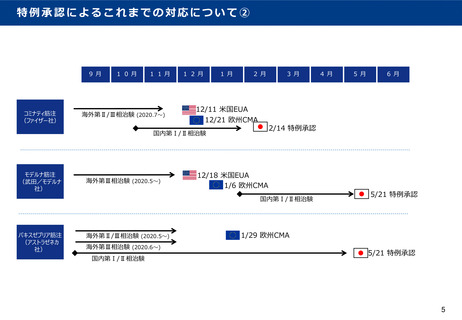
特例承認によるこれまでの対応について①
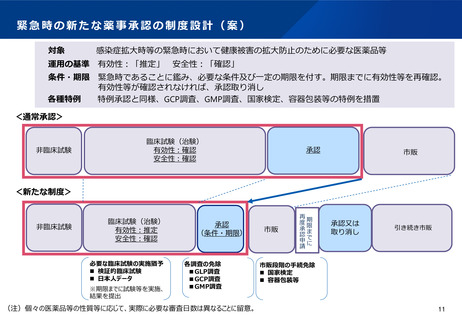
○ 特例承認制度では、 GMP調査、国家検定、容器包装等の各種特例が措置されており、一定程度の薬
事承認の早期化が可能。
○ 今回の新型コロナウイルス感染症では、外国で使用許可等され流通していたワクチンや治療薬について、特
例承認で対応したところ。
※ この他、特例承認制度により、新型インフルエンザ(A/H1N1)のワクチン2品目をこれまでに承認
○ しかし、特例承認制度は
・ 国内企業が世界に先駆けて開発し、国内での承認申請が行われた場合には適用できない
・ 通常の承認制度と同様に、有効性・安全性の「確認」が承認の要件であることから、日本人で
の安全性、有効性を確認するための臨床データが不十分な場合には、その確認のため国内治験を追加
で実施しなければならないことがある
等の課題がある。
○ このため、欧米等のデータのみで判断するのではなく、日本人を対象とした一定の治験を国内で行うなど、承
認審査のためのデータ収集及び手続を丁寧に行ったことにより、承認まで時間を要した品目も存在し、我が
国における特例承認のタイミングは、新型コロナワクチンについては、先進諸外国の緊急時の薬事許可等と比べ、
数ヶ月程度の差があった。
※
国内治験の実施期間は、感染状況や病院等の治験実施体制等に左右される。
※ 米国には、緊急使用許可(Emergency Use Authorization(EUA))
EUには、条件付き販売承認(Conditional marketing authorisation(CMA)) と言った制度が存在する。
4
○ 特例承認制度では、 GMP調査、国家検定、容器包装等の各種特例が措置されており、一定程度の薬
事承認の早期化が可能。
○ 今回の新型コロナウイルス感染症では、外国で使用許可等され流通していたワクチンや治療薬について、特
例承認で対応したところ。
※ この他、特例承認制度により、新型インフルエンザ(A/H1N1)のワクチン2品目をこれまでに承認
○ しかし、特例承認制度は
・ 国内企業が世界に先駆けて開発し、国内での承認申請が行われた場合には適用できない
・ 通常の承認制度と同様に、有効性・安全性の「確認」が承認の要件であることから、日本人で
の安全性、有効性を確認するための臨床データが不十分な場合には、その確認のため国内治験を追加
で実施しなければならないことがある
等の課題がある。
○ このため、欧米等のデータのみで判断するのではなく、日本人を対象とした一定の治験を国内で行うなど、承
認審査のためのデータ収集及び手続を丁寧に行ったことにより、承認まで時間を要した品目も存在し、我が
国における特例承認のタイミングは、新型コロナワクチンについては、先進諸外国の緊急時の薬事許可等と比べ、
数ヶ月程度の差があった。
※
国内治験の実施期間は、感染状況や病院等の治験実施体制等に左右される。
※ 米国には、緊急使用許可(Emergency Use Authorization(EUA))
EUには、条件付き販売承認(Conditional marketing authorisation(CMA)) と言った制度が存在する。
4