よむ、つかう、まなぶ。
資料1.緊急時の薬事承認の在り方. (22 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_22502.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和3度第2回 12/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
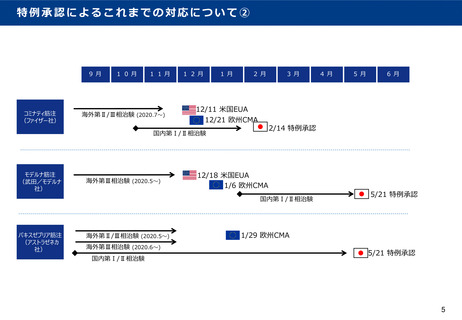
(参考)特例承認によるこれまでの対応について
ワクチンの評価に関する国際的なコンセンサスを踏まえたPMDAのガイダンス
<有効性の評価>
○ 原則として、発症予防効果を主要評価項目として大規模な臨床試験を実施する必要がある。
<国内臨床試験における評価>
○ 国・地域による流行状況やウイルス株の違い、民族的要因の差等を踏まえると、国内で臨床試験を
実施し、日本人被験者における有効性及び安全性を検討する必要がある。
<海外開発型のワクチン候補、有効性の評価>
○ 海外で発症予防効果を主要評価項目とした大規模な検証的臨床試験が実施される場合には、国内で
日本人における免疫原性(抗体価等)及び安全性を確認することを目的とした国内臨床試験を実施す
ることで十分な場合がある。
予防接種法及び検疫法の一部を改正する法律案に対する附帯決議
【衆議院附帯決議】(令和2年11月18日)
三 新しい技術を活用した新型コロナウイルスワクチンの審査に当たっては、その使用実績が乏しく、
安全性及び有効性等についての情報量に制約があることから、国内外の治験結果を踏まえ、慎重に行
うこと。
【参議院附帯決議】(令和2年12月1日)
二 新しい技術を活用した新型コロナウイルスワクチンの承認審査に当たっては、その使用実績が乏し
く、安全性及び有効性等についての情報量に制約があることから、国内外の治験結果等を踏まえ、慎
重に行うこと。
22
ワクチンの評価に関する国際的なコンセンサスを踏まえたPMDAのガイダンス
<有効性の評価>
○ 原則として、発症予防効果を主要評価項目として大規模な臨床試験を実施する必要がある。
<国内臨床試験における評価>
○ 国・地域による流行状況やウイルス株の違い、民族的要因の差等を踏まえると、国内で臨床試験を
実施し、日本人被験者における有効性及び安全性を検討する必要がある。
<海外開発型のワクチン候補、有効性の評価>
○ 海外で発症予防効果を主要評価項目とした大規模な検証的臨床試験が実施される場合には、国内で
日本人における免疫原性(抗体価等)及び安全性を確認することを目的とした国内臨床試験を実施す
ることで十分な場合がある。
予防接種法及び検疫法の一部を改正する法律案に対する附帯決議
【衆議院附帯決議】(令和2年11月18日)
三 新しい技術を活用した新型コロナウイルスワクチンの審査に当たっては、その使用実績が乏しく、
安全性及び有効性等についての情報量に制約があることから、国内外の治験結果を踏まえ、慎重に行
うこと。
【参議院附帯決議】(令和2年12月1日)
二 新しい技術を活用した新型コロナウイルスワクチンの承認審査に当たっては、その使用実績が乏し
く、安全性及び有効性等についての情報量に制約があることから、国内外の治験結果等を踏まえ、慎
重に行うこと。
22