よむ、つかう、まなぶ。
総-5-5○最適使用推進ガイドラインについて (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00173.html |
| 出典情報 | 中央社会保険医療協議会 総会(第536回 1/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
4. 施設について
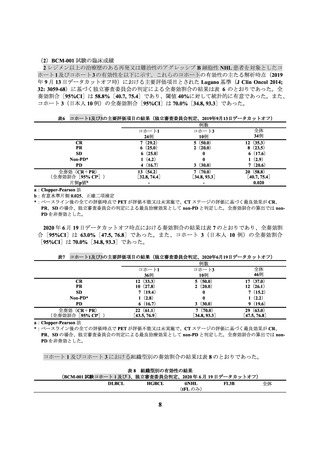
本品の製造には白血球アフェレーシスが必要なこと、LD 化学療法や本品の投与に際して重篤な
有害事象が認められる可能性が高いことから、本品の投与が適切な患者を診断・特定し、本品の投
与により重篤な副作用が発現した際に対応することが必要である。したがって、本品は以下の①~
③のすべてを満たす施設において使用する必要がある。
① 施設について
①-1
下記の(1)~(4)のすべてに該当する施設であること
(1) 日本造血・免疫細胞療法学会が定める移植施設認定基準の全ての項目を満たす診療科(認定
カテゴリー1)又は認定カテゴリー1 に準ずる診療科(認定基準のうち、移植コーディネータ
ーの配置に係る基準以外を満たす診療科)を有すること。
(2) 有害事象に対する全身管理が可能な ICU 等を有していること(A301 特定集中治療室管理料
(1 日につき)「1」特定集中治療室管理料 1 から「4」特定集中治療室管理料 4 のいずれか
を届け出ている医療機関)。
(3) アフェレーシス機器の使用に熟知した医療スタッフ(医師、看護師、臨床検査技師又は臨床
工学技士)が配置されており、アフェレーシス中には少なくとも 1 名の医療スタッフ(医
師、看護師、臨床検査技師又は臨床工学技士)による常時監視体制及び医師への連絡体制が
整っていること。
(4) 本品の有効性及び安全性に関する情報を収集するため、関連学会との連携の下で運営される
本品の「患者登録システム(レジストリ)」に患者登録を行うとともに、本品に課せられて
いる製造販売後調査を適切に実施することが可能であること。
①-2
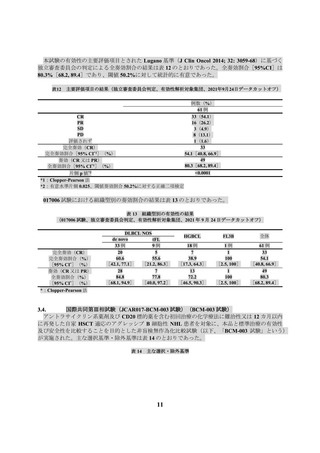
表 24:
(1)
(2)
(3)
大細胞型 B 細胞リンパ腫及び濾胞性リンパ腫の診断、治療及び不具合・副作用発現時の対応
に十分な知識と経験を有し、製造販売業者が実施する、本品の使用にあたっての講習を修了
した医師が、治療の責任者を含めて複数名配置されていること。具体的には、表 24 の(1)~
(3)のすべてに該当する医師が治療の責任者として 1 名配置されているとともに、表 24 の(1)
に該当する医師が 1 名以上配置されていること。
治療の責任者等に関する要件
医師免許取得後、6 年以上の臨床経験を有し、うち 3 年以上は、血液悪性腫瘍の研修を行っていること。
造血細胞移植に関する研修による診療実績が通算 1 年以上あり、必要な経験と学識技術を習得しているこ
と。
同種造血細胞移植の診療実績が 5 例以上あること。
② 院内の再生医療等製品に関する情報管理の体制について
再生医療等製品に関する情報管理に従事する担当者が配置され、製造販売業者からの情報窓口、有
効性・安全性等に関する情報の管理及び医師等に対する情報提供、不具合・副作用が発生した場合
の報告に係る業務等が速やかに行われる体制が整っていること。
22
本品の製造には白血球アフェレーシスが必要なこと、LD 化学療法や本品の投与に際して重篤な
有害事象が認められる可能性が高いことから、本品の投与が適切な患者を診断・特定し、本品の投
与により重篤な副作用が発現した際に対応することが必要である。したがって、本品は以下の①~
③のすべてを満たす施設において使用する必要がある。
① 施設について
①-1
下記の(1)~(4)のすべてに該当する施設であること
(1) 日本造血・免疫細胞療法学会が定める移植施設認定基準の全ての項目を満たす診療科(認定
カテゴリー1)又は認定カテゴリー1 に準ずる診療科(認定基準のうち、移植コーディネータ
ーの配置に係る基準以外を満たす診療科)を有すること。
(2) 有害事象に対する全身管理が可能な ICU 等を有していること(A301 特定集中治療室管理料
(1 日につき)「1」特定集中治療室管理料 1 から「4」特定集中治療室管理料 4 のいずれか
を届け出ている医療機関)。
(3) アフェレーシス機器の使用に熟知した医療スタッフ(医師、看護師、臨床検査技師又は臨床
工学技士)が配置されており、アフェレーシス中には少なくとも 1 名の医療スタッフ(医
師、看護師、臨床検査技師又は臨床工学技士)による常時監視体制及び医師への連絡体制が
整っていること。
(4) 本品の有効性及び安全性に関する情報を収集するため、関連学会との連携の下で運営される
本品の「患者登録システム(レジストリ)」に患者登録を行うとともに、本品に課せられて
いる製造販売後調査を適切に実施することが可能であること。
①-2
表 24:
(1)
(2)
(3)
大細胞型 B 細胞リンパ腫及び濾胞性リンパ腫の診断、治療及び不具合・副作用発現時の対応
に十分な知識と経験を有し、製造販売業者が実施する、本品の使用にあたっての講習を修了
した医師が、治療の責任者を含めて複数名配置されていること。具体的には、表 24 の(1)~
(3)のすべてに該当する医師が治療の責任者として 1 名配置されているとともに、表 24 の(1)
に該当する医師が 1 名以上配置されていること。
治療の責任者等に関する要件
医師免許取得後、6 年以上の臨床経験を有し、うち 3 年以上は、血液悪性腫瘍の研修を行っていること。
造血細胞移植に関する研修による診療実績が通算 1 年以上あり、必要な経験と学識技術を習得しているこ
と。
同種造血細胞移植の診療実績が 5 例以上あること。
② 院内の再生医療等製品に関する情報管理の体制について
再生医療等製品に関する情報管理に従事する担当者が配置され、製造販売業者からの情報窓口、有
効性・安全性等に関する情報の管理及び医師等に対する情報提供、不具合・副作用が発生した場合
の報告に係る業務等が速やかに行われる体制が整っていること。
22