よむ、つかう、まなぶ。
総-5-5○最適使用推進ガイドラインについて (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00173.html |
| 出典情報 | 中央社会保険医療協議会 総会(第536回 1/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
コホート 2
コホート 2 で本品が投与された 27 例において、有害事象は 26 例(96.3%)に認められ、副作用は
24 例(88.9%)に認められた(データカットオフ日:2022 年 3 月 2 日)。全グレードの発現割合が
5%以上の副作用は表 21 のとおりであった。
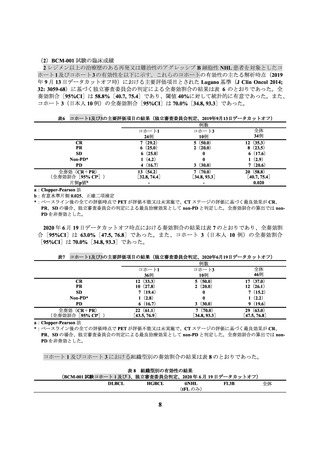
表 21
全グレードの発現割合が 5%以上の副作用
(JCAR017-BCM-001 試験コホート 2、データカットオフ日:2022 年 3 月 2 日)
患者数 (%)
N = 27
器官別大分類
基本語
(MedDRA/J Ver. 23.0)
全副作用
血液およびリンパ系障害
好中球減少症
血小板減少症
貧血
白血球減少症
リンパ球減少症
免疫系障害
サイトカイン放出症候群
一般・全身障害および投与部位の状態
発熱
無力症
神経系障害
振戦
臨床検査
血中フィブリノゲン減少
CTCAE ver. 4.03
全グレード
24 ( 88.9)
グレード 3 以上
16 ( 59.3)
15 ( 55.6)
7 ( 25.9)
5 ( 18.5)
4 ( 14.8)
2 ( 7.4)
14 ( 51.9)
5 ( 18.5)
3 ( 11.1)
3 ( 11.1)
1 ( 3.7)
13 ( 48.1)
0
8 ( 29.6)
2 ( 7.4)
0
0
2 ( 7.4)
0
2 ( 7.4)
1 ( 3.7)
本品の投与後から 30 日以内の死亡は認められなかった。本品の投与後 31 日目以降の有害事象に
よる死亡は 1 例に認められた。死因は血球貪食性リンパ組織球症であり、本品との因果関係が否定
されなかった。その他、投与後 31 日目以降に、疾患進行により 11 例が死亡した。
3.7.
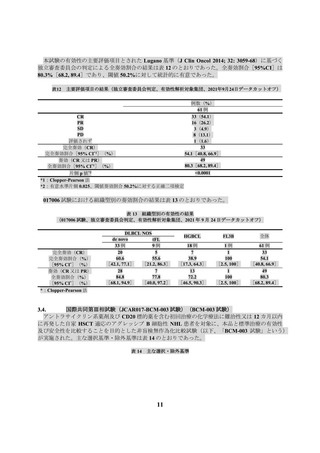
海外第Ⅱ相試験(017006 試験)
本試験で本品が投与された 61 例において、有害事象は 59 例(96.7%)に認められ、副作用は 48
例(78.7%)に認められた(データカットオフ日:2021 年 9 月 24 日)。全グレードの発現割合が
5%以上の副作用は表 22 のとおりであった。
表 22 全グレードの発現割合が 5%以上の副作用(017006 試験、データカットオフ日:2021 年 9 月 24 日)
患者数 (%)
N=61
器官別大分類
基本語
(MedDRA/J Ver. 23.0)
全副作用
免疫系障害
サイトカイン放出症候群
19
全グレード
48 ( 78.7)
グレード 3 以上
27 ( 44.3)
23 ( 37.7)
1 ( 1.6)
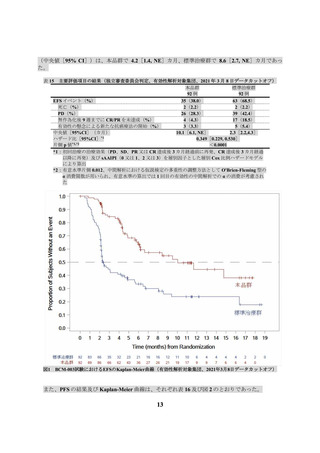
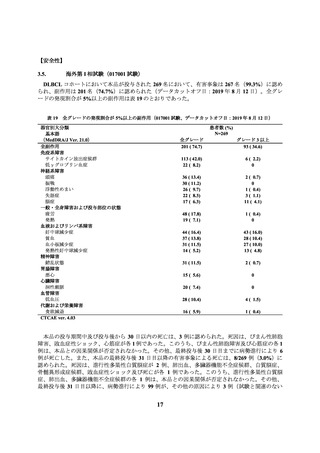
コホート 2 で本品が投与された 27 例において、有害事象は 26 例(96.3%)に認められ、副作用は
24 例(88.9%)に認められた(データカットオフ日:2022 年 3 月 2 日)。全グレードの発現割合が
5%以上の副作用は表 21 のとおりであった。
表 21
全グレードの発現割合が 5%以上の副作用
(JCAR017-BCM-001 試験コホート 2、データカットオフ日:2022 年 3 月 2 日)
患者数 (%)
N = 27
器官別大分類
基本語
(MedDRA/J Ver. 23.0)
全副作用
血液およびリンパ系障害
好中球減少症
血小板減少症
貧血
白血球減少症
リンパ球減少症
免疫系障害
サイトカイン放出症候群
一般・全身障害および投与部位の状態
発熱
無力症
神経系障害
振戦
臨床検査
血中フィブリノゲン減少
CTCAE ver. 4.03
全グレード
24 ( 88.9)
グレード 3 以上
16 ( 59.3)
15 ( 55.6)
7 ( 25.9)
5 ( 18.5)
4 ( 14.8)
2 ( 7.4)
14 ( 51.9)
5 ( 18.5)
3 ( 11.1)
3 ( 11.1)
1 ( 3.7)
13 ( 48.1)
0
8 ( 29.6)
2 ( 7.4)
0
0
2 ( 7.4)
0
2 ( 7.4)
1 ( 3.7)
本品の投与後から 30 日以内の死亡は認められなかった。本品の投与後 31 日目以降の有害事象に
よる死亡は 1 例に認められた。死因は血球貪食性リンパ組織球症であり、本品との因果関係が否定
されなかった。その他、投与後 31 日目以降に、疾患進行により 11 例が死亡した。
3.7.
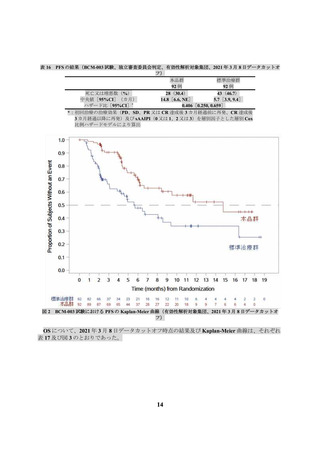
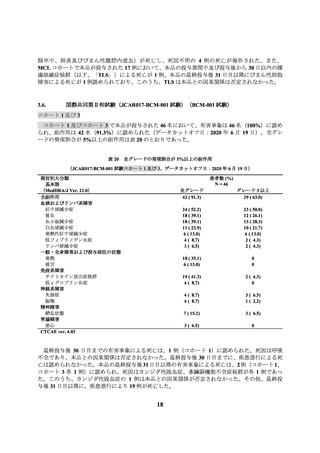
海外第Ⅱ相試験(017006 試験)
本試験で本品が投与された 61 例において、有害事象は 59 例(96.7%)に認められ、副作用は 48
例(78.7%)に認められた(データカットオフ日:2021 年 9 月 24 日)。全グレードの発現割合が
5%以上の副作用は表 22 のとおりであった。
表 22 全グレードの発現割合が 5%以上の副作用(017006 試験、データカットオフ日:2021 年 9 月 24 日)
患者数 (%)
N=61
器官別大分類
基本語
(MedDRA/J Ver. 23.0)
全副作用
免疫系障害
サイトカイン放出症候群
19
全グレード
48 ( 78.7)
グレード 3 以上
27 ( 44.3)
23 ( 37.7)
1 ( 1.6)