よむ、つかう、まなぶ。
参考資料4-4 特例承認医薬品の市販直後調査報告書 (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29975.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和4年度第22回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
2022年6月
医療関係者の皆さまへ
中外製薬株式会社
安全管理責任者
ロナプリーブ注射液セット300・1332
―SARS-CoV-2による感染症及びその発症抑制―
副作用収集状況のご報告
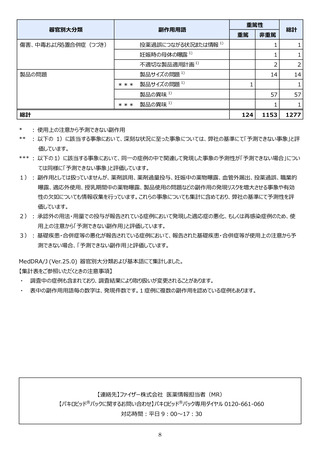
本報告の対象期間
治療:IV 2021年7月22日 ~ 2022年1月21日
発症抑制:IV、SC、治療:SC 2021年11月5日~2022年5月4日
謹啓 先生方におかれましては、ますますご清祥のこととお慶び申し上げます。平素は格別のご厚誼
にあずかり、厚く御礼申し上げます。
さて、弊社は、2021年7月19日に「SARS-CoV-2による感染症(以下、治療)」を効能又は効果とし
て、「点滴静注(以下、IV)」の用法において「ロナプリーブ点滴静注セット300、同1332(一般名:
カシリビマブ(遺伝子組換え)/イムデビマブ(遺伝子組換え)(以下、本剤)」の特例承認を取得い
たしました。その後、2021年11月5日に「SARS-CoV-2による感染症の発症抑制(以下、発症抑制)」
の効能又は効果および「皮下注射(以下、SC)」の用法において、特例承認を追加取得いたしました。
本剤は医薬品リスク管理計画書に基づき市販直後調査(以下、本調査)を実施いたしました。
このたび、市販直後調査期間に収集された副作用の収集状況につきましてご報告いたしますので、
ご一読いただき日常診療にお役立てくださいますようお願い申し上げます。
謹白
●市販直後調査の実施期間
治療:IV
2021年7月22日~2022年1月21日
発症抑制:IV、SC、治療:SC 2021年11月5日~2022年5月4日
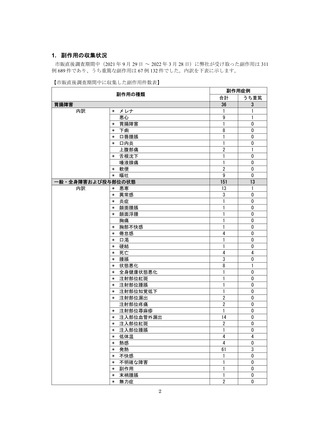
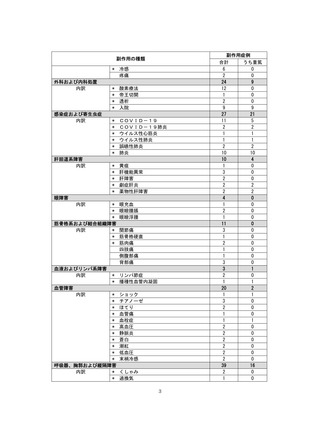
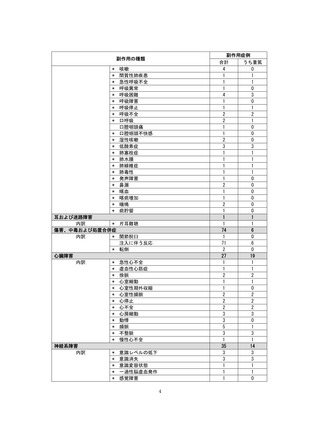
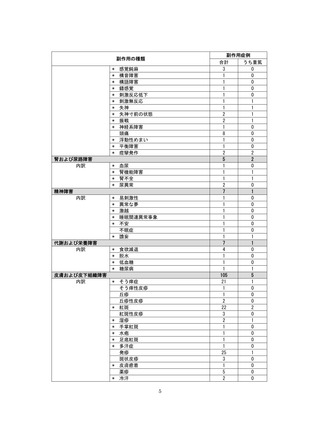
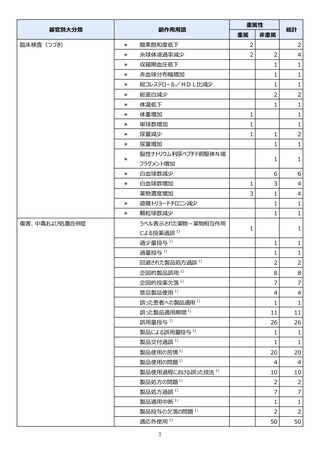
●副作用の収集状況
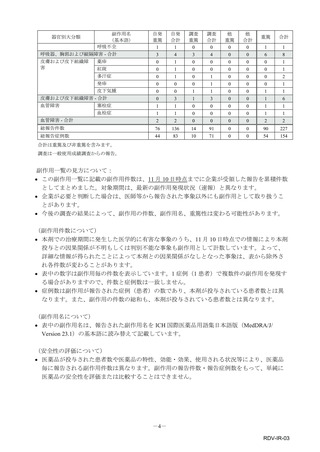
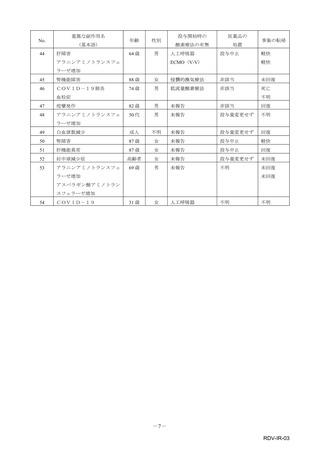
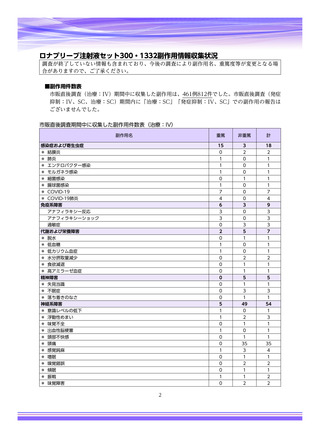
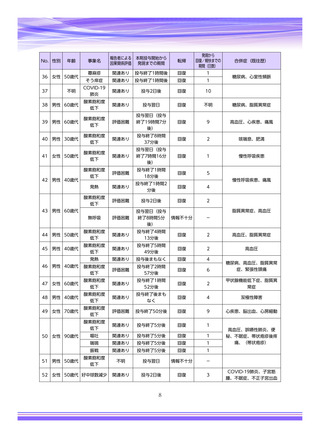
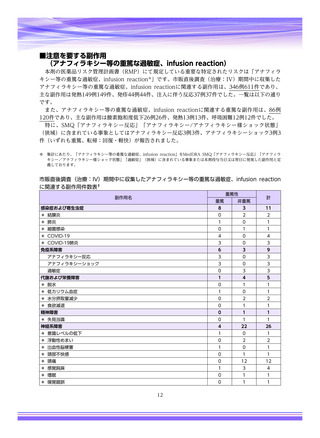
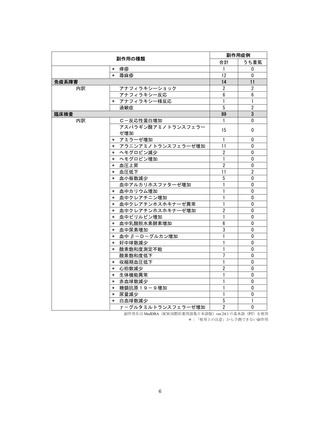
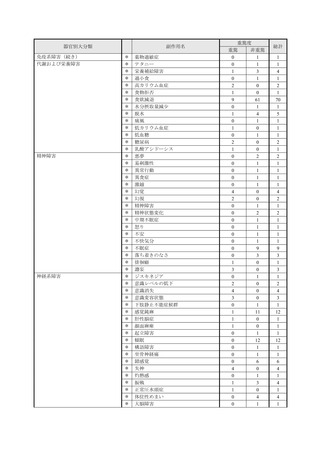
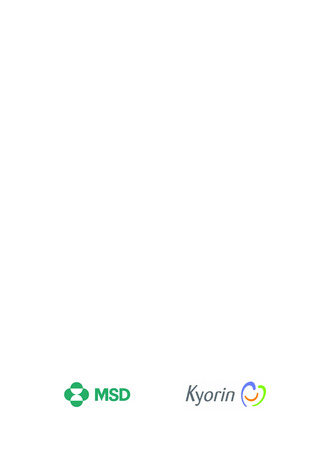
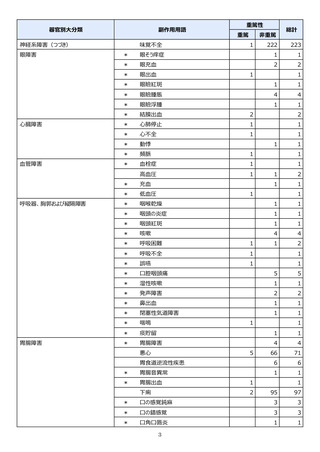
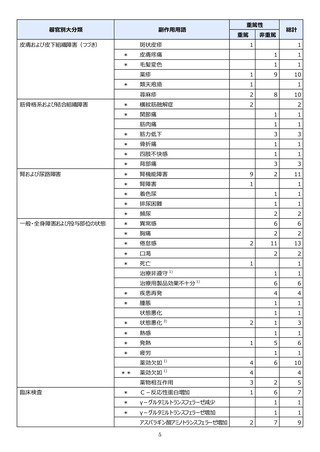
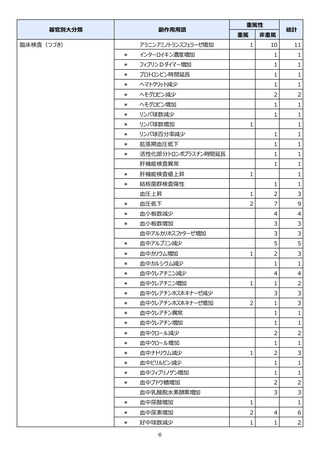
【治療:IV(集計期間:2021年7月22日~2022年1月21日)】
全副作用
主な副作用(治療)
重篤な副作用
主な副作用(治療)
461例812件
発熱 221例221件、発疹 44例44件、酸素飽和度低下 38例38件
106例153件
酸素飽和度低下 27例27件、発熱 18例18件、呼吸困難 12例12件
※本剤との因果関係が否定できないと判断された事象(因果関係が報告されていない事象を含む)を示しています。副作用名は報告された副
作用名をMedDRA/J(国際医学用語集の一つ)ver.24.1の基本語(PT)に読み替えています。
※参考:上記副作用報告のベースとなる推定使用患者数(2022年1月21日時点):治療:IV 34840例
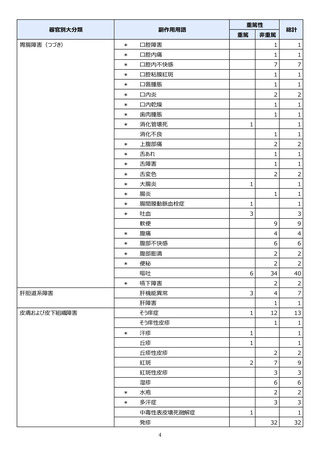
【発症抑制:IV、SC、治療:SC(集計期間:2021年11月5日~2022年5月4日)】
本集計期間内に副作用の報告はございませんでした。
※参考:上記副作用報告のベースとなる推定使用患者数(2022年5月4日時点):366例(治療: SC 66例、発症抑制:IV 230例、SC 70例)
承認以降の詳細情報について
より詳細な情報は、弊社ウェブサイトの副作用データベースツールより確認可能です。ウェブサイ
トの詳細は本資材の最終ページをご参照ください。
臨床試験(COV-2067試験及びCOV-2069試験)の詳細情報について
海外第I/II/III相試験(COV-2067試験)、海外第III相試験(COV-2069試験)の情報は、適正使
用ガイドにてご確認ください。
1
医療関係者の皆さまへ
中外製薬株式会社
安全管理責任者
ロナプリーブ注射液セット300・1332
―SARS-CoV-2による感染症及びその発症抑制―
副作用収集状況のご報告
本報告の対象期間
治療:IV 2021年7月22日 ~ 2022年1月21日
発症抑制:IV、SC、治療:SC 2021年11月5日~2022年5月4日
謹啓 先生方におかれましては、ますますご清祥のこととお慶び申し上げます。平素は格別のご厚誼
にあずかり、厚く御礼申し上げます。
さて、弊社は、2021年7月19日に「SARS-CoV-2による感染症(以下、治療)」を効能又は効果とし
て、「点滴静注(以下、IV)」の用法において「ロナプリーブ点滴静注セット300、同1332(一般名:
カシリビマブ(遺伝子組換え)/イムデビマブ(遺伝子組換え)(以下、本剤)」の特例承認を取得い
たしました。その後、2021年11月5日に「SARS-CoV-2による感染症の発症抑制(以下、発症抑制)」
の効能又は効果および「皮下注射(以下、SC)」の用法において、特例承認を追加取得いたしました。
本剤は医薬品リスク管理計画書に基づき市販直後調査(以下、本調査)を実施いたしました。
このたび、市販直後調査期間に収集された副作用の収集状況につきましてご報告いたしますので、
ご一読いただき日常診療にお役立てくださいますようお願い申し上げます。
謹白
●市販直後調査の実施期間
治療:IV
2021年7月22日~2022年1月21日
発症抑制:IV、SC、治療:SC 2021年11月5日~2022年5月4日
●副作用の収集状況
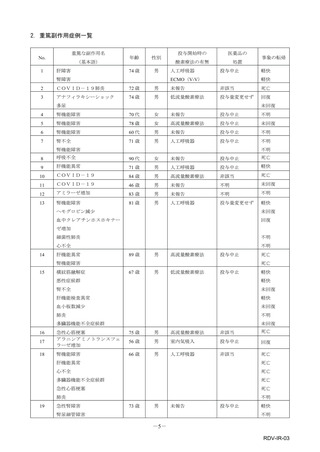
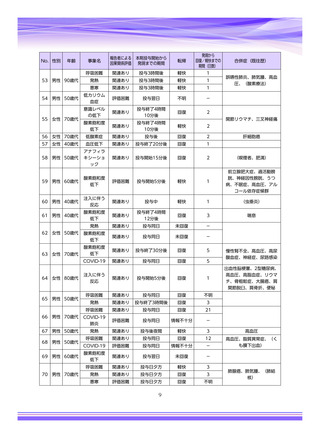
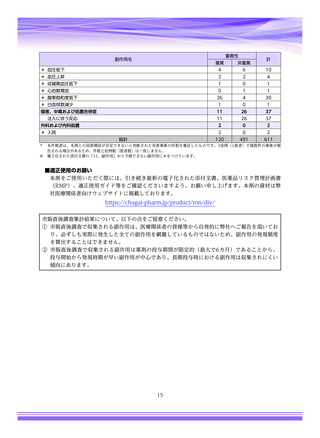
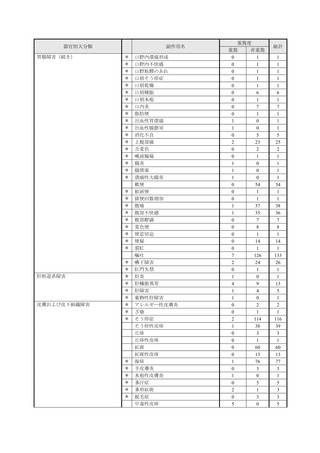
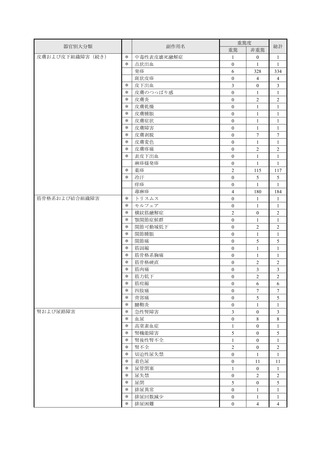
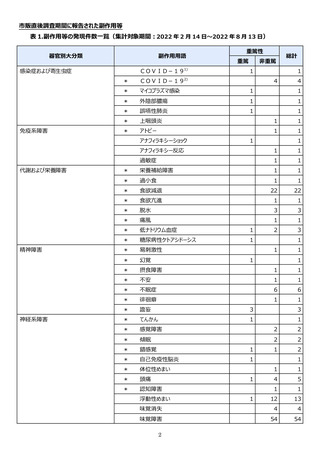
【治療:IV(集計期間:2021年7月22日~2022年1月21日)】
全副作用
主な副作用(治療)
重篤な副作用
主な副作用(治療)
461例812件
発熱 221例221件、発疹 44例44件、酸素飽和度低下 38例38件
106例153件
酸素飽和度低下 27例27件、発熱 18例18件、呼吸困難 12例12件
※本剤との因果関係が否定できないと判断された事象(因果関係が報告されていない事象を含む)を示しています。副作用名は報告された副
作用名をMedDRA/J(国際医学用語集の一つ)ver.24.1の基本語(PT)に読み替えています。
※参考:上記副作用報告のベースとなる推定使用患者数(2022年1月21日時点):治療:IV 34840例
【発症抑制:IV、SC、治療:SC(集計期間:2021年11月5日~2022年5月4日)】
本集計期間内に副作用の報告はございませんでした。
※参考:上記副作用報告のベースとなる推定使用患者数(2022年5月4日時点):366例(治療: SC 66例、発症抑制:IV 230例、SC 70例)
承認以降の詳細情報について
より詳細な情報は、弊社ウェブサイトの副作用データベースツールより確認可能です。ウェブサイ
トの詳細は本資材の最終ページをご参照ください。
臨床試験(COV-2067試験及びCOV-2069試験)の詳細情報について
海外第I/II/III相試験(COV-2067試験)、海外第III相試験(COV-2069試験)の情報は、適正使
用ガイドにてご確認ください。
1