よむ、つかう、まなぶ。
【資料No.1】★審査報告書(3) (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
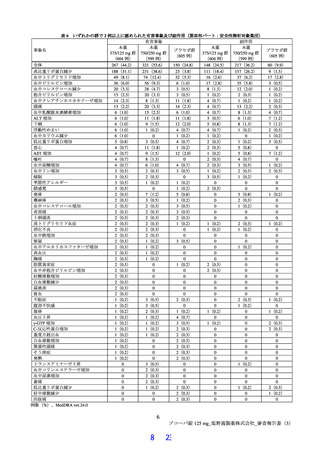
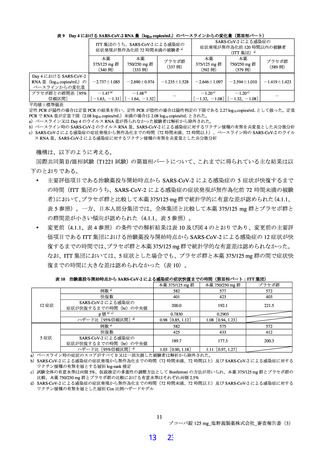
表9
Day 4 における SARS-CoV-2 RNA 量(log10 copies/mL)のベースラインからの変化量(第Ⅲ相パート)
SARS-CoV-2 による感染症の
ITT 集団のうち、SARS-CoV-2 による感染症の
症状発現が無作為化前 120 時間以内の被験者
症状発現が無作為化前 72 時間未満の被験者 a)
(ITT 集団)a)
本薬
本薬
本薬
本薬
プラセボ群
プラセボ群
375/125 mg 群
750/250 mg 群
375/125 mg 群
750/250 mg 群
(337 例)
(589 例)
(340 例)
(333 例)
(592 例)
(579 例)
Day 4 における SARS-CoV-2
RNA 量(log10 copies/mL)の -2.737±1.085 -2.690±0.974 -1.235±1.528 -2.646±1.097 -2.594±1.010 -1.419±1.423
ベースラインからの変化量
プラセボ群との群間差[95%
-1.47 b)
-1.48 b)
-1.20 c)
-1.20 c)
-
-
信頼区間]
[-1.63, -1.31][-1.64, -1.32]
[-1.32, -1.08][-1.32, -1.08]
平均値±標準偏差
定性 PCR が陽性の場合は定量 PCR の結果を用い、定性 PCR が陰性の場合は陽性判定の下限である 2.27 log10 copies/mL として扱った。定量
PCR で RNA 量が定量下限(2.08 log10 copies/mL)未満の場合は 2.08 log10 copies/mL とされた。
a)ベースライン又は Day 4 のウイルス RNA 量が得られなかった被験者は解析から除外された。
b)ベースライン時の SARS-CoV-2 のウイルス RNA 量、SARS-CoV-2 による感染症に対するワクチン接種の有無を共変量とした共分散分析
c)SARS-CoV-2 による感染症の症状発現から無作為化までの時間(72 時間未満、72 時間以上)、ベースライン時の SARS-CoV-2 のウイル
ス RNA 量、SARS-CoV-2 による感染症に対するワクチン接種の有無を共変量とした共分散分析
機構は、以下のように考える。
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅲ相パートについて、これまでに得られている主な結果は以
下のとおりである。
主要評価項目である治験薬投与開始時点から SARS-CoV-2 による感染症の 5 症状が快復するまで
の時間(ITT 集団のうち、SARS-CoV-2 による感染症の症状発現が無作為化前 72 時間未満の被験
者)において、
プラセボ群と比較して本薬 375/125 mg 群で統計学的に有意な差が認められた(4.1.1、
表 5 参照)。一方、日本人部分集団では、全体集団と比較して本薬 375/125 mg 群とプラセボ群と
の群間差が小さい傾向が認められた(4.1.1、表 5 参照)。
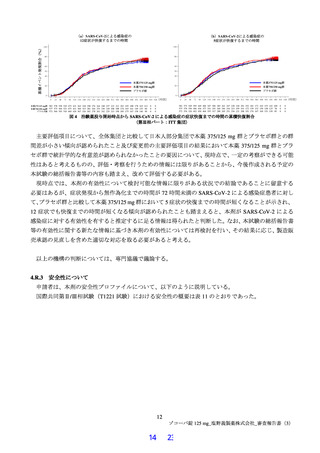
変更前(4.1.1、表 4 参照)の条件での解析結果は表 10 及び図 4 のとおりであり、変更前の主要評
価項目である ITT 集団における治験薬投与開始時点から SARS-CoV-2 による感染症の 12 症状が快
復するまでの時間では、
プラセボ群と本薬 375/125 mg 群で統計学的な有意差は認められなかった。
なお、ITT 集団においては、5 症状とした場合でも、プラセボ群と本薬 375/125 mg 群の間で症状快
復までの時間に大きな差は認められなかった(表 10)。
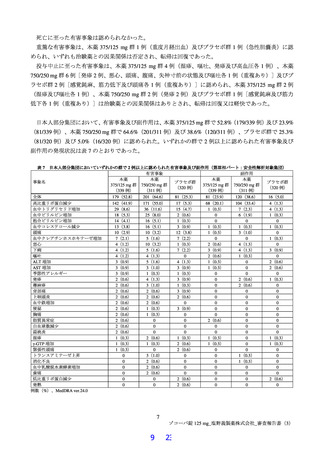
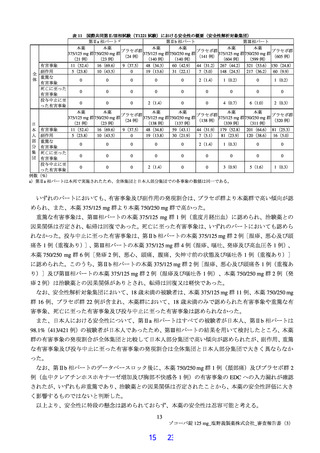
表 10 治験薬投与開始時点から SARS-CoV-2 による感染症の症状快復までの時間(第Ⅲ相パート:ITT 集団)
本薬 375/125 mg 群
本薬 750/250 mg 群
プラセボ群
例数 a)
582
577
572
快復数
401
423
403
SARS-CoV-2 による感染症の
12 症状
200.0
192.1
221.5
症状が快復するまでの時間(hr)の中央値
b)c)
p値
0.7830
0.2903
ハザード比[95%信頼区間]d)
0.98[0.85, 1.12]
1.08[0.94, 1.23]
例数 a)
582
575
572
快復数
425
433
412
5 症状
SARS-CoV-2 による感染症の
189.7
177.3
200.3
症状が快復するまでの時間(hr)の中央値
d)
ハザード比[95%信頼区間]
1.03[0.90, 1.18]
1.11[0.97, 1.27]
a)ベースライン時の症状のスコアがすべて 0 又は一部欠測した被験者は解析から除外された。
b)SARS-CoV-2 による感染症の症状発現から無作為化までの時間(72 時間未満、72 時間以上)及び SARS-CoV-2 による感染症に対する
ワクチン接種の有無を層とする層別 log-rank 検定
c)試験全体の有意水準は両側 5%、仮説検定の多重性の調整方法として Bonferroni の方法が用いられ、本薬 375/125 mg 群とプラセボ群の
比較、本薬 750/250 mg 群とプラセボ群の比較における有意水準はそれぞれ両側 2.5%
d)SARS-CoV-2 による感染症の症状発現から無作為化までの時間(72 時間未満、72 時間以上)及び SARS-CoV-2 による感染症に対する
ワクチン接種の有無を層とした層別 Cox 比例ハザードモデル
11
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書(3)
13 / 23
Day 4 における SARS-CoV-2 RNA 量(log10 copies/mL)のベースラインからの変化量(第Ⅲ相パート)
SARS-CoV-2 による感染症の
ITT 集団のうち、SARS-CoV-2 による感染症の
症状発現が無作為化前 120 時間以内の被験者
症状発現が無作為化前 72 時間未満の被験者 a)
(ITT 集団)a)
本薬
本薬
本薬
本薬
プラセボ群
プラセボ群
375/125 mg 群
750/250 mg 群
375/125 mg 群
750/250 mg 群
(337 例)
(589 例)
(340 例)
(333 例)
(592 例)
(579 例)
Day 4 における SARS-CoV-2
RNA 量(log10 copies/mL)の -2.737±1.085 -2.690±0.974 -1.235±1.528 -2.646±1.097 -2.594±1.010 -1.419±1.423
ベースラインからの変化量
プラセボ群との群間差[95%
-1.47 b)
-1.48 b)
-1.20 c)
-1.20 c)
-
-
信頼区間]
[-1.63, -1.31][-1.64, -1.32]
[-1.32, -1.08][-1.32, -1.08]
平均値±標準偏差
定性 PCR が陽性の場合は定量 PCR の結果を用い、定性 PCR が陰性の場合は陽性判定の下限である 2.27 log10 copies/mL として扱った。定量
PCR で RNA 量が定量下限(2.08 log10 copies/mL)未満の場合は 2.08 log10 copies/mL とされた。
a)ベースライン又は Day 4 のウイルス RNA 量が得られなかった被験者は解析から除外された。
b)ベースライン時の SARS-CoV-2 のウイルス RNA 量、SARS-CoV-2 による感染症に対するワクチン接種の有無を共変量とした共分散分析
c)SARS-CoV-2 による感染症の症状発現から無作為化までの時間(72 時間未満、72 時間以上)、ベースライン時の SARS-CoV-2 のウイル
ス RNA 量、SARS-CoV-2 による感染症に対するワクチン接種の有無を共変量とした共分散分析
機構は、以下のように考える。
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅲ相パートについて、これまでに得られている主な結果は以
下のとおりである。
主要評価項目である治験薬投与開始時点から SARS-CoV-2 による感染症の 5 症状が快復するまで
の時間(ITT 集団のうち、SARS-CoV-2 による感染症の症状発現が無作為化前 72 時間未満の被験
者)において、
プラセボ群と比較して本薬 375/125 mg 群で統計学的に有意な差が認められた(4.1.1、
表 5 参照)。一方、日本人部分集団では、全体集団と比較して本薬 375/125 mg 群とプラセボ群と
の群間差が小さい傾向が認められた(4.1.1、表 5 参照)。
変更前(4.1.1、表 4 参照)の条件での解析結果は表 10 及び図 4 のとおりであり、変更前の主要評
価項目である ITT 集団における治験薬投与開始時点から SARS-CoV-2 による感染症の 12 症状が快
復するまでの時間では、
プラセボ群と本薬 375/125 mg 群で統計学的な有意差は認められなかった。
なお、ITT 集団においては、5 症状とした場合でも、プラセボ群と本薬 375/125 mg 群の間で症状快
復までの時間に大きな差は認められなかった(表 10)。
表 10 治験薬投与開始時点から SARS-CoV-2 による感染症の症状快復までの時間(第Ⅲ相パート:ITT 集団)
本薬 375/125 mg 群
本薬 750/250 mg 群
プラセボ群
例数 a)
582
577
572
快復数
401
423
403
SARS-CoV-2 による感染症の
12 症状
200.0
192.1
221.5
症状が快復するまでの時間(hr)の中央値
b)c)
p値
0.7830
0.2903
ハザード比[95%信頼区間]d)
0.98[0.85, 1.12]
1.08[0.94, 1.23]
例数 a)
582
575
572
快復数
425
433
412
5 症状
SARS-CoV-2 による感染症の
189.7
177.3
200.3
症状が快復するまでの時間(hr)の中央値
d)
ハザード比[95%信頼区間]
1.03[0.90, 1.18]
1.11[0.97, 1.27]
a)ベースライン時の症状のスコアがすべて 0 又は一部欠測した被験者は解析から除外された。
b)SARS-CoV-2 による感染症の症状発現から無作為化までの時間(72 時間未満、72 時間以上)及び SARS-CoV-2 による感染症に対する
ワクチン接種の有無を層とする層別 log-rank 検定
c)試験全体の有意水準は両側 5%、仮説検定の多重性の調整方法として Bonferroni の方法が用いられ、本薬 375/125 mg 群とプラセボ群の
比較、本薬 750/250 mg 群とプラセボ群の比較における有意水準はそれぞれ両側 2.5%
d)SARS-CoV-2 による感染症の症状発現から無作為化までの時間(72 時間未満、72 時間以上)及び SARS-CoV-2 による感染症に対する
ワクチン接種の有無を層とした層別 Cox 比例ハザードモデル
11
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書(3)
13 / 23