よむ、つかう、まなぶ。
【資料No.1】★審査報告書(3) (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
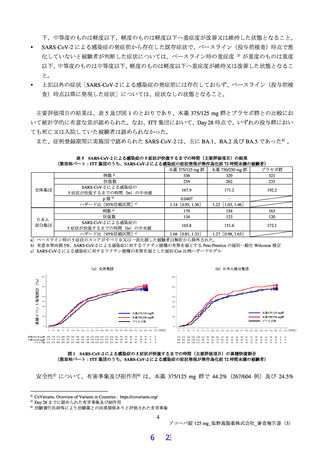
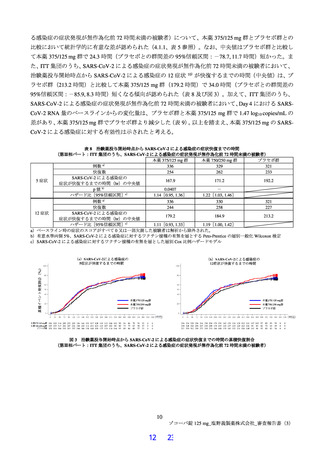
本薬は症状悪化前に投与することで治療効果が最大となると考えられたことに加え、前述の国内情
報 7)において、入院患者の発症から症状悪化までの日数が 3 日以内である患者が約 6 割を占めたこ
と等から、有効性の主要な解析対象を SARS-CoV-2 による感染症の症状発現が無作為化8)前 72 時間
未満の被験者とすることが適切と考えられた。
以上の有効性の主要評価項目及び解析対象集団の変更に伴い必要被験者数を変更した(4.1.1 参照)。
また、第Ⅱb 相パートの結果を踏まえて、以下の変更を行った。
第Ⅱb 相パートの結果から用量間で有効性に明確な差はなく、低用量でも十分な抗ウイルス効果が確
認でき、本薬の催奇形性リスクや薬物相互作用のリスクに対するマージンを大きくすることも考慮
し、本薬 375/125 mg のみを有効性の検証対象に変更した。
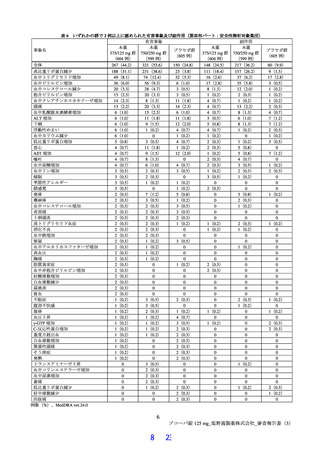
第Ⅱb 相パートの本薬 375/125 mg 群における SARS-CoV-2 による感染症の 5 症状9)が快復する被験
者の割合を検討した結果、治験薬投与開始から早期の時点でプラセボ群との群間差が大きく、観察終
了時は小さくなっていた点を考慮し、すべての時点を通じて等しい重みを用いる層別 log-rank 検定よ
り、早期の時点でのイベントに大きな重みを与える Peto-Prentice の層別一般化 Wilcoxon 検定を用い
ることが適当との考えに基づき、検定方法を変更した。
機構は、以下のように考える。
開鍵直前に主要評価項目や有効性の主要な解析対象集団等(4.1.1、表 4 参照)の変更を行ったことは、
盲検下であっても試験結果の信頼性を低下させる行為であり、適切ではなかったと考え、変更後の試験結
果に加えて、変更前の条件での解析結果も確認した上で、本剤の有効性について検討することとした
(4.R.2 参照)。
ただし、本薬の開発が SARS-CoV-2 の感染拡大が繰り返す中で行われ、治療薬開発の速度に関する国内
の関心の高さに加え、以下の点を踏まえると、有効性の主要評価項目及び解析対象集団の変更は否定され
るものではないと考える。
評価対象となる症状に関して、変更後の 5 症状は、変更前の 12 症状10)にも含まれており、新たに出
現した SARS-CoV-2 による感染症に特徴的な症状ではないこと等を考慮すると、多様な症状が発現
する疾患として 12 症状による評価を行うことにも臨床的に一定の合理性があったと考えるものの、
発現割合の多い 5 症状で評価することにも一定の意義はあるとする考えを否定するものではない。
ワクチン接種の進捗や流行株の変異により重症化する患者の割合が低下した状況下であって、抗ウイ
ルス作用が主たる作用機序である本薬の開発において、発症初期の患者を対象に症状緩和を有効性の
評価指標とすることには、一定の論理性があると考える。
4.R.2 有効性について
申請者は、SARS-CoV-2 による感染症患者における本剤の有効性について、以下のように説明している。
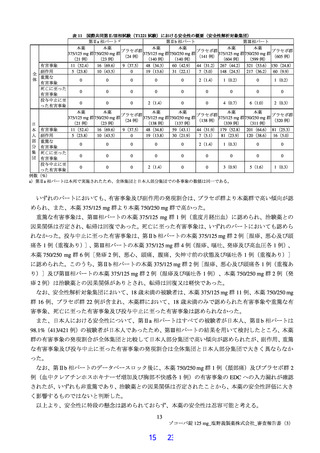
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅲ相パートにおいて、主要評価項目である治験薬投与開始時
点から SARS-CoV-2 による感染症の 5 症状 9)が快復するまでの時間(ITT 集団のうち、SARS-CoV-2 によ
無作為化は Day 1(許容幅-1 日)、治験薬投与開始日は Day 1 と設定された。
申請者は、第Ⅲ相パートにおいて、以下の SARS-CoV-2 による感染症の 5 症状を用いて有効性を評価することとしたと説明している。
①倦怠感又は疲労感、②熱っぽさ又は発熱、③鼻水又は鼻づまり、④喉の痛み、⑤咳
10)
SARS-CoV-2 による感染症の 12 症状:①倦怠感又は疲労感、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発汗、⑤熱っぽさ又は発熱、
⑥鼻水又は鼻づまり、⑦喉の痛み、⑧咳、⑨息切れ(呼吸困難)、⑩吐き気、⑪嘔吐、⑫下痢
8)
9)
9
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書(3)
11 / 23
本薬は症状悪化前に投与することで治療効果が最大となると考えられたことに加え、前述の国内情
報 7)において、入院患者の発症から症状悪化までの日数が 3 日以内である患者が約 6 割を占めたこ
と等から、有効性の主要な解析対象を SARS-CoV-2 による感染症の症状発現が無作為化8)前 72 時間
未満の被験者とすることが適切と考えられた。
以上の有効性の主要評価項目及び解析対象集団の変更に伴い必要被験者数を変更した(4.1.1 参照)。
また、第Ⅱb 相パートの結果を踏まえて、以下の変更を行った。
第Ⅱb 相パートの結果から用量間で有効性に明確な差はなく、低用量でも十分な抗ウイルス効果が確
認でき、本薬の催奇形性リスクや薬物相互作用のリスクに対するマージンを大きくすることも考慮
し、本薬 375/125 mg のみを有効性の検証対象に変更した。
第Ⅱb 相パートの本薬 375/125 mg 群における SARS-CoV-2 による感染症の 5 症状9)が快復する被験
者の割合を検討した結果、治験薬投与開始から早期の時点でプラセボ群との群間差が大きく、観察終
了時は小さくなっていた点を考慮し、すべての時点を通じて等しい重みを用いる層別 log-rank 検定よ
り、早期の時点でのイベントに大きな重みを与える Peto-Prentice の層別一般化 Wilcoxon 検定を用い
ることが適当との考えに基づき、検定方法を変更した。
機構は、以下のように考える。
開鍵直前に主要評価項目や有効性の主要な解析対象集団等(4.1.1、表 4 参照)の変更を行ったことは、
盲検下であっても試験結果の信頼性を低下させる行為であり、適切ではなかったと考え、変更後の試験結
果に加えて、変更前の条件での解析結果も確認した上で、本剤の有効性について検討することとした
(4.R.2 参照)。
ただし、本薬の開発が SARS-CoV-2 の感染拡大が繰り返す中で行われ、治療薬開発の速度に関する国内
の関心の高さに加え、以下の点を踏まえると、有効性の主要評価項目及び解析対象集団の変更は否定され
るものではないと考える。
評価対象となる症状に関して、変更後の 5 症状は、変更前の 12 症状10)にも含まれており、新たに出
現した SARS-CoV-2 による感染症に特徴的な症状ではないこと等を考慮すると、多様な症状が発現
する疾患として 12 症状による評価を行うことにも臨床的に一定の合理性があったと考えるものの、
発現割合の多い 5 症状で評価することにも一定の意義はあるとする考えを否定するものではない。
ワクチン接種の進捗や流行株の変異により重症化する患者の割合が低下した状況下であって、抗ウイ
ルス作用が主たる作用機序である本薬の開発において、発症初期の患者を対象に症状緩和を有効性の
評価指標とすることには、一定の論理性があると考える。
4.R.2 有効性について
申請者は、SARS-CoV-2 による感染症患者における本剤の有効性について、以下のように説明している。
国際共同第Ⅱ/Ⅲ相試験(T1221 試験)の第Ⅲ相パートにおいて、主要評価項目である治験薬投与開始時
点から SARS-CoV-2 による感染症の 5 症状 9)が快復するまでの時間(ITT 集団のうち、SARS-CoV-2 によ
無作為化は Day 1(許容幅-1 日)、治験薬投与開始日は Day 1 と設定された。
申請者は、第Ⅲ相パートにおいて、以下の SARS-CoV-2 による感染症の 5 症状を用いて有効性を評価することとしたと説明している。
①倦怠感又は疲労感、②熱っぽさ又は発熱、③鼻水又は鼻づまり、④喉の痛み、⑤咳
10)
SARS-CoV-2 による感染症の 12 症状:①倦怠感又は疲労感、②筋肉痛又は体の痛み、③頭痛、④悪寒又は発汗、⑤熱っぽさ又は発熱、
⑥鼻水又は鼻づまり、⑦喉の痛み、⑧咳、⑨息切れ(呼吸困難)、⑩吐き気、⑪嘔吐、⑫下痢
8)
9)
9
ゾコーバ錠 125 mg_塩野義製薬株式会社_審査報告書(3)
11 / 23