よむ、つかう、まなぶ。
資料1 CSTI第三次報告を踏まえた ART 指針の見直し の検討 について(案) (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29015.html |
| 出典情報 | ヒト受精胚等へのゲノム編集技術等を用いる研究に関する合同会議(再設置第3回 11/7)《厚生労働省》《文部科学省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
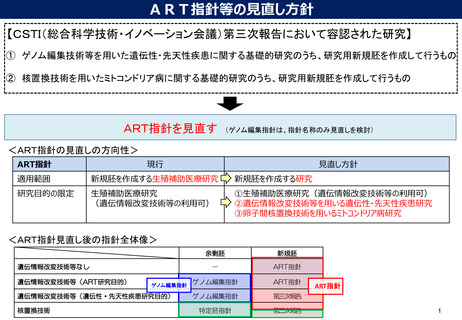
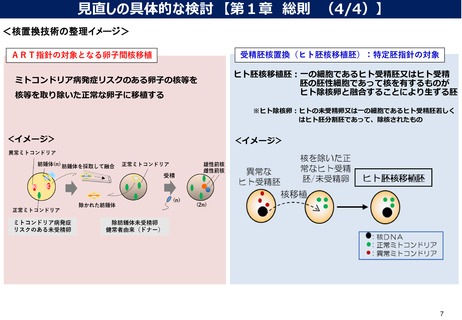
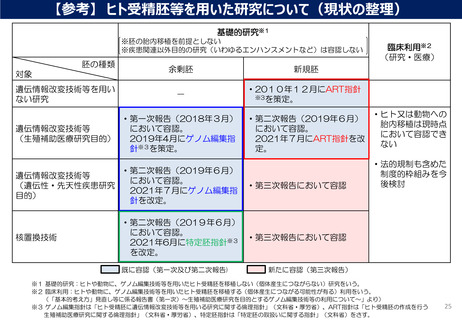
見直しの検討が必要な事項②
CSTI第三次報告を受け、ART指針の見直しの検討が必要項目は、下記赤字部分と考えられる
ART指針の構成
第4章 研究の体制
第1 研究機関
第2 提供機関
第3 研究機関と提供機関が同一である
場合の要件
見直しの検討内容
研究機関の基準及び研究責任者の要件(第1の1、3)
・ 遺伝性又は先天性疾患研究に関する基準/要件の追加
・ 卵子間核置換技術の追加に当たり、追加すべき要件があ
るか検討
研究機関の倫理審査委員会(第1の4)
・ 遺伝性又は先天性疾患研究追加に当たり、追加すべき要
件があるか検討(提供機関の倫理審査委員会の要件につ
いては引き続き研究機関の倫理審査委員会の要件を準用
でよいか)
・ 卵子間核置換技術の追加に当たり、追加すべき要件があ
るか検討
第5章
第1
第2
第3
第4
第5
第6
第7
研究の手続
研究計画の実施
研究計画の変更
研究の進行状況の報告
研究の終了
個人情報の保護
遺伝情報の取扱い
研究成果の公開等
第6章 雑則
第1 指針不適合の公表
第2 見直し
第3 施行期日
卵子間核置換技術の追加に当たり、研究計画書に記載する
事項について追加すべきものがあるか
3
CSTI第三次報告を受け、ART指針の見直しの検討が必要項目は、下記赤字部分と考えられる
ART指針の構成
第4章 研究の体制
第1 研究機関
第2 提供機関
第3 研究機関と提供機関が同一である
場合の要件
見直しの検討内容
研究機関の基準及び研究責任者の要件(第1の1、3)
・ 遺伝性又は先天性疾患研究に関する基準/要件の追加
・ 卵子間核置換技術の追加に当たり、追加すべき要件があ
るか検討
研究機関の倫理審査委員会(第1の4)
・ 遺伝性又は先天性疾患研究追加に当たり、追加すべき要
件があるか検討(提供機関の倫理審査委員会の要件につ
いては引き続き研究機関の倫理審査委員会の要件を準用
でよいか)
・ 卵子間核置換技術の追加に当たり、追加すべき要件があ
るか検討
第5章
第1
第2
第3
第4
第5
第6
第7
研究の手続
研究計画の実施
研究計画の変更
研究の進行状況の報告
研究の終了
個人情報の保護
遺伝情報の取扱い
研究成果の公開等
第6章 雑則
第1 指針不適合の公表
第2 見直し
第3 施行期日
卵子間核置換技術の追加に当たり、研究計画書に記載する
事項について追加すべきものがあるか
3