よむ、つかう、まなぶ。
費-4 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000182080_00006.html |
| 出典情報 | 中央社会保険医療協議会 費用対効果評価専門部会(第55回 8/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
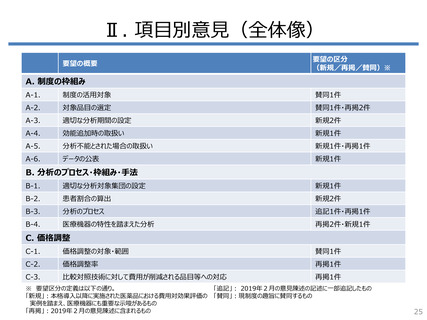
医療機器の特性に起因する評価上の課題
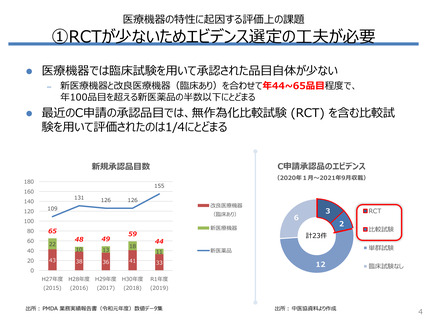
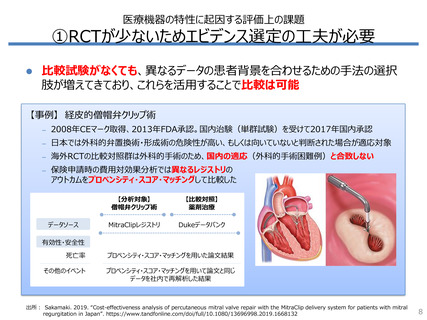
①RCTが少ないためエビデンス選定の工夫が必要
海外のHTA審査機関は、RCT以外の多様なエビデンスを用いて医療機器の
評価を行っている
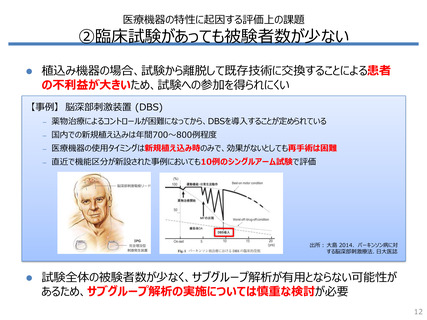
RCTが使用された割合は、医薬品では9割超だが医療機器では7割未満
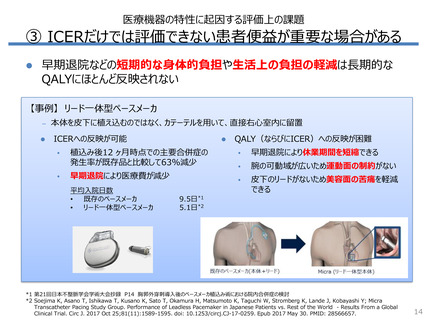
– 非無作為化比較試験や観察研究が使用された割合は、医療機器では
医薬品の3倍以上
–
海外HTAでRCTが使われた割合*1
100%
94%
80%
67%
60%
40%
20%
海外HTAで評価されたエビデンスの種類別件数*1
20
18
16
14
12
10
8
6
4
2
0
17
18
3倍
Drug (N = 18)
4.3倍
4
3
1
Non-RCTs
Observational
studies
Evidence
synthesis
2
Other
Device (N = 27)
Drug (N = 18)
*1
8
6
RCTs
0%
13
12
Device (N = 27)
EUの資金によって医療機器のHTAの枠組みを研究するために実施されたMedtecHTAプロジェクトの一環として行われた研究結果。2003年~2014年に報告された心血
管領域の医薬・医療機器に関する技術評価報告書(英文)について検討したもの。
出所: Ciani, O. et al. Linking the Regulatory and Reimbursement Processes for Medical Devices: The Need for Integrated Assessments. Health
Econ. 26(Suppl. 1): 13–29 (2017)
9
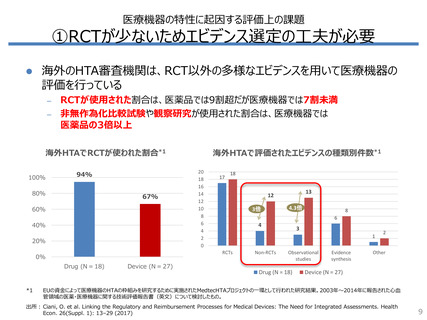
①RCTが少ないためエビデンス選定の工夫が必要
海外のHTA審査機関は、RCT以外の多様なエビデンスを用いて医療機器の
評価を行っている
RCTが使用された割合は、医薬品では9割超だが医療機器では7割未満
– 非無作為化比較試験や観察研究が使用された割合は、医療機器では
医薬品の3倍以上
–
海外HTAでRCTが使われた割合*1
100%
94%
80%
67%
60%
40%
20%
海外HTAで評価されたエビデンスの種類別件数*1
20
18
16
14
12
10
8
6
4
2
0
17
18
3倍
Drug (N = 18)
4.3倍
4
3
1
Non-RCTs
Observational
studies
Evidence
synthesis
2
Other
Device (N = 27)
Drug (N = 18)
*1
8
6
RCTs
0%
13
12
Device (N = 27)
EUの資金によって医療機器のHTAの枠組みを研究するために実施されたMedtecHTAプロジェクトの一環として行われた研究結果。2003年~2014年に報告された心血
管領域の医薬・医療機器に関する技術評価報告書(英文)について検討したもの。
出所: Ciani, O. et al. Linking the Regulatory and Reimbursement Processes for Medical Devices: The Need for Integrated Assessments. Health
Econ. 26(Suppl. 1): 13–29 (2017)
9