よむ、つかう、まなぶ。
【資料4】医薬・生活衛生局からの定期報告 (24 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26381.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第8回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
※2
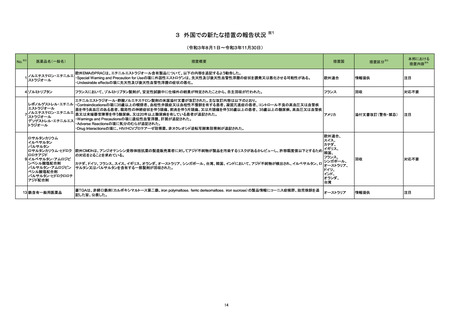
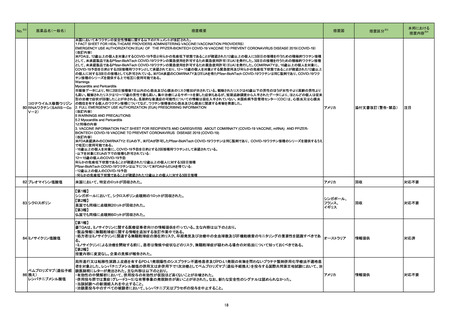
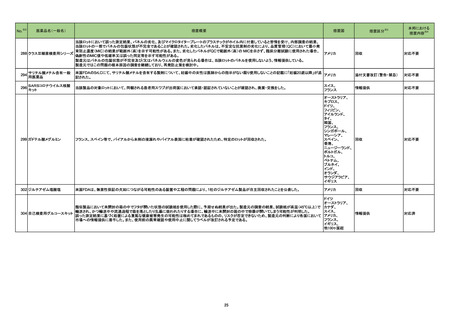
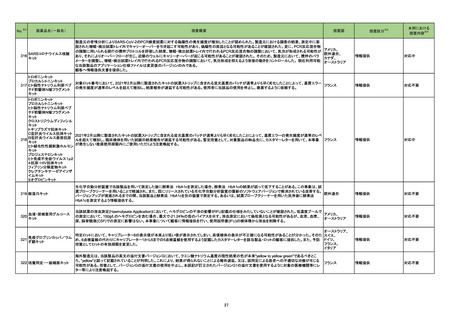
No.
医薬品名(一般名)
措置概要
豪州TGAは、医薬品中のnitrosamine不純物に関する調査及び対応について、全ての医薬品の製造販売業者、消費者、医療従事者に対して情報提供を行っ
た。
○製造販売業者に対しては、以下内容を公表した。
・医薬品中のnitrosamine不純物の問題に関する調査を行い、最新情報を公表すること。
ビルダグリプチン・メトホルミ ・製造販売業者の責務として、本件についてモニタリングを行い、適宜、TGAに報告を行うこと。
275
オーストラリア
ン塩酸塩配合剤
○消費者及び医療従事者に対しては、以下内容を公表した。
・現時点ではTGAは喫緊の健康リスクがないと考えられていること。
・消費者は、医療従事者に相談をする前に自身で判断して投与を中止してはならないこと。
・医療従事者は本件を把握し患者への説明をすること。
・TGAの対応内容については現在調査中であるが、今後措置を検討すること。
276
※3
措置国
トロピカミド・フェニレフリン塩 米国において、無菌性保証の欠如につながる可能性のある製品として、約240ロットに対し自主的な病院の薬局レベルでのリコールを開始したことを発表した。
アメリカ
酸塩
リコール対象製品に、フェニレフリンの0.9%塩化ナトリウム溶液が含まれている。
措置区分
本邦における
措置内容※4
情報提供
注目
回収
対応不要
279 ジクロフェナクナトリウム
米国FDAにて、警告の妊娠若しくは授乳中に服用をしない期間として「妊娠20週以降」を追記した。
アメリカ
添付文書改訂(警告・禁忌)
対応済
280 アスピリン
米国FDAは、妊娠約20週以降における非ステロイド性抗炎症薬(NSAIDs:aspirin,ibuprofen,naproxen,diclofenac,celecoxibなどの解熱鎮痛剤)の使用
は、胎児に稀ではあるが重篤な腎障害を引き起こすと警告した。この障害により、胎児を取り巻く羊水のレベルが低下し、合併症を引き起こす可能性がある。
そのため、現在のNSAIDsの添付文書に記載されている妊娠30週ではなく、妊娠20週以降の妊婦におけるNSAIDsの使用を避けるよう勧告した。
アメリカ
添付文書改訂(警告・禁忌)
対応済
トラマドール塩酸塩・アセトア
ミノフェン配合剤
サリチル酸メチル・グリチル
レチン酸配合剤
サリチル酸メチル含有一般 米国FDAのSrLCにて、NSAIDsを含有する製剤について、妊娠中の女性は医師からの指示がない限り使用しないことの記載に「妊娠20週以降」が追記され
281
用医薬品
た。
フェルビナク含有一般用医薬
品
ジクロフェナクナトリウム含有
一般用医薬品
アメリカ
添付文書改訂(警告・禁忌)
対応済
スウェーデン医薬品庁は、Direct Healthcare Professional Communicationを更新した。DHPCの概要は以下のとおり。
・網膜血管炎,網膜血管閉塞を含む眼内炎症は,ブロルシズマブの初回の硝子体内注射後及び治療のいかなる時期でも生じ得る。これらの事象は治療の早
期に頻繁に観察されている。
・治療中に抗ブロルシズマブ抗体を生じた患者では,より多くの眼内炎症の事象がみられている。
ブロルシズマブ(遺伝子組換 ・網膜血管炎,網膜血管閉塞を含む眼内炎症を生じた患者では治療を中止し,発現した事象に対し速やかに管理を行うこと。
282
え)
・本剤維持期(最初の3回の投与以降)の投与では,8週間未満の間隔で投与しないこと。
・本剤治療の前の年に眼内炎症や網膜血管閉塞の病歴がある患者では,網膜血管炎,網膜血管閉塞を発症するリスクが高いため,注意深く観察すること。
・女性が追加のリスクファクターであることが特定された。また,日本人患者において,高い発生率がみられた。
・眼内炎症、網膜血管炎及び網膜血管閉塞の初期徴候及び症状を認識する方法を患者に指導し,これらの副作用が疑われる場合は直ちに医療機関を受診
するよう患者を指導すること。
スウェーデン
情報提供
対応中
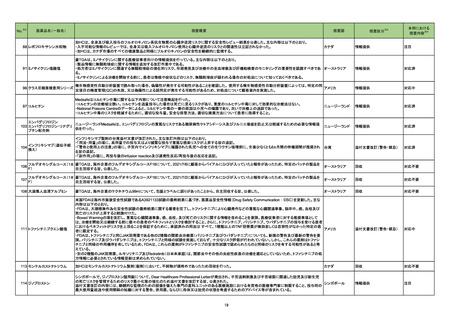
アメリカ
添付文書改訂(警告・禁忌)
対応済
283 ジクロフェナクナトリウム
米国FDAのSrLCにて、ジクロフェナクナトリウムを含有する製剤について、妊娠中の女性は医師からの指示がない限り使用しないことの記載に「妊娠20週以
降」が追記された。
285
精製ヒアルロン酸ナトリウム
精製ヒアルロン酸ナトリウム・ フランスにおいて、ヒアルロン酸含有眼粘弾剤が輸送における最高温度を超える温度に製品が暴露した可能性があり臨床性能に影響を与える可能性があると
フランス
コンドロイチン硫酸エステル して、回収が行われた。
ナトリウム
回収
対応不要
286
アセトアミノフェン含有一般用 米国FDAのSrLCにて、アセトアミノフェン、アスピリン、カフェインを含有する製剤について、妊娠中の女性は医師からの指示がない限り使用しないことの記載
医薬品
に「妊娠20週以降」が追記された。
添付文書改訂(警告・禁忌)
対応不要
24
アメリカ
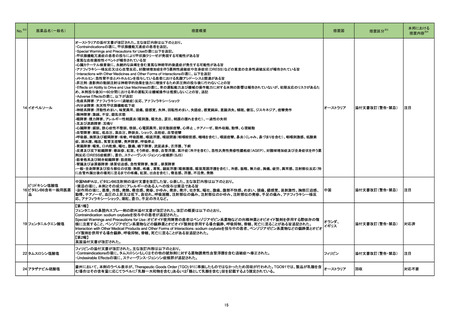
No.
医薬品名(一般名)
措置概要
豪州TGAは、医薬品中のnitrosamine不純物に関する調査及び対応について、全ての医薬品の製造販売業者、消費者、医療従事者に対して情報提供を行っ
た。
○製造販売業者に対しては、以下内容を公表した。
・医薬品中のnitrosamine不純物の問題に関する調査を行い、最新情報を公表すること。
ビルダグリプチン・メトホルミ ・製造販売業者の責務として、本件についてモニタリングを行い、適宜、TGAに報告を行うこと。
275
オーストラリア
ン塩酸塩配合剤
○消費者及び医療従事者に対しては、以下内容を公表した。
・現時点ではTGAは喫緊の健康リスクがないと考えられていること。
・消費者は、医療従事者に相談をする前に自身で判断して投与を中止してはならないこと。
・医療従事者は本件を把握し患者への説明をすること。
・TGAの対応内容については現在調査中であるが、今後措置を検討すること。
276
※3
措置国
トロピカミド・フェニレフリン塩 米国において、無菌性保証の欠如につながる可能性のある製品として、約240ロットに対し自主的な病院の薬局レベルでのリコールを開始したことを発表した。
アメリカ
酸塩
リコール対象製品に、フェニレフリンの0.9%塩化ナトリウム溶液が含まれている。
措置区分
本邦における
措置内容※4
情報提供
注目
回収
対応不要
279 ジクロフェナクナトリウム
米国FDAにて、警告の妊娠若しくは授乳中に服用をしない期間として「妊娠20週以降」を追記した。
アメリカ
添付文書改訂(警告・禁忌)
対応済
280 アスピリン
米国FDAは、妊娠約20週以降における非ステロイド性抗炎症薬(NSAIDs:aspirin,ibuprofen,naproxen,diclofenac,celecoxibなどの解熱鎮痛剤)の使用
は、胎児に稀ではあるが重篤な腎障害を引き起こすと警告した。この障害により、胎児を取り巻く羊水のレベルが低下し、合併症を引き起こす可能性がある。
そのため、現在のNSAIDsの添付文書に記載されている妊娠30週ではなく、妊娠20週以降の妊婦におけるNSAIDsの使用を避けるよう勧告した。
アメリカ
添付文書改訂(警告・禁忌)
対応済
トラマドール塩酸塩・アセトア
ミノフェン配合剤
サリチル酸メチル・グリチル
レチン酸配合剤
サリチル酸メチル含有一般 米国FDAのSrLCにて、NSAIDsを含有する製剤について、妊娠中の女性は医師からの指示がない限り使用しないことの記載に「妊娠20週以降」が追記され
281
用医薬品
た。
フェルビナク含有一般用医薬
品
ジクロフェナクナトリウム含有
一般用医薬品
アメリカ
添付文書改訂(警告・禁忌)
対応済
スウェーデン医薬品庁は、Direct Healthcare Professional Communicationを更新した。DHPCの概要は以下のとおり。
・網膜血管炎,網膜血管閉塞を含む眼内炎症は,ブロルシズマブの初回の硝子体内注射後及び治療のいかなる時期でも生じ得る。これらの事象は治療の早
期に頻繁に観察されている。
・治療中に抗ブロルシズマブ抗体を生じた患者では,より多くの眼内炎症の事象がみられている。
ブロルシズマブ(遺伝子組換 ・網膜血管炎,網膜血管閉塞を含む眼内炎症を生じた患者では治療を中止し,発現した事象に対し速やかに管理を行うこと。
282
え)
・本剤維持期(最初の3回の投与以降)の投与では,8週間未満の間隔で投与しないこと。
・本剤治療の前の年に眼内炎症や網膜血管閉塞の病歴がある患者では,網膜血管炎,網膜血管閉塞を発症するリスクが高いため,注意深く観察すること。
・女性が追加のリスクファクターであることが特定された。また,日本人患者において,高い発生率がみられた。
・眼内炎症、網膜血管炎及び網膜血管閉塞の初期徴候及び症状を認識する方法を患者に指導し,これらの副作用が疑われる場合は直ちに医療機関を受診
するよう患者を指導すること。
スウェーデン
情報提供
対応中
アメリカ
添付文書改訂(警告・禁忌)
対応済
283 ジクロフェナクナトリウム
米国FDAのSrLCにて、ジクロフェナクナトリウムを含有する製剤について、妊娠中の女性は医師からの指示がない限り使用しないことの記載に「妊娠20週以
降」が追記された。
285
精製ヒアルロン酸ナトリウム
精製ヒアルロン酸ナトリウム・ フランスにおいて、ヒアルロン酸含有眼粘弾剤が輸送における最高温度を超える温度に製品が暴露した可能性があり臨床性能に影響を与える可能性があると
フランス
コンドロイチン硫酸エステル して、回収が行われた。
ナトリウム
回収
対応不要
286
アセトアミノフェン含有一般用 米国FDAのSrLCにて、アセトアミノフェン、アスピリン、カフェインを含有する製剤について、妊娠中の女性は医師からの指示がない限り使用しないことの記載
医薬品
に「妊娠20週以降」が追記された。
添付文書改訂(警告・禁忌)
対応不要
24
アメリカ