よむ、つかう、まなぶ。
【資料4】医薬・生活衛生局からの定期報告 (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26381.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第8回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
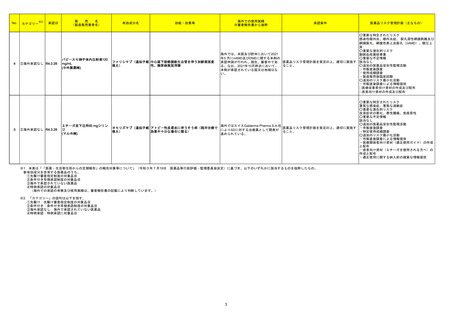
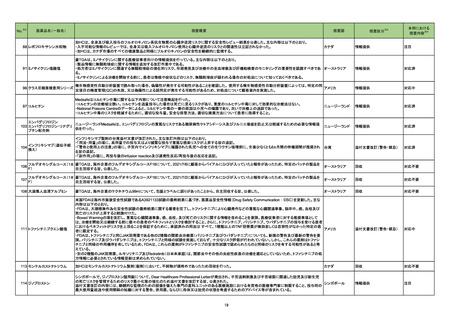
※2
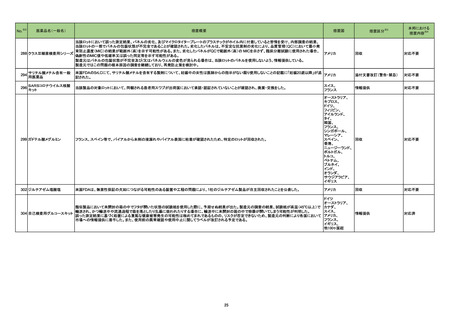
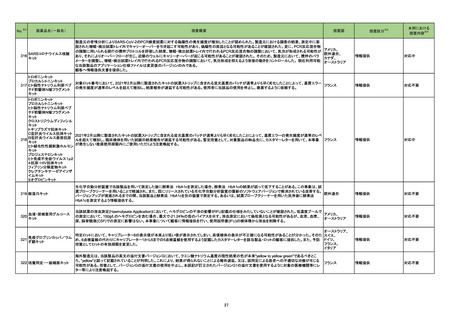
No.
医薬品名(一般名)
措置概要
※3
措置国
措置区分
本邦における
措置内容※4
米国において本ワクチンの安全性情報に関する以下のドキュメントが改訂された。
1.FACT SHEET FOR HEALTHCARE PROVIDERS ADMINISTERING VACCINE(VACCINATION PROVIDERS)
EMERGENCY USE AUTHORIZATION(EUA) OF THE PFIZER-BIONTECH COVID-19 VACCINE TO PREVENT CORONAVIRUS DISEASE 2019(COVID-19)
(改訂内容)
米FDAは、12歳以上の個人を対象とするCOVID-19予防と何らかの免疫低下状態であることが確認された12歳以上の個人に3回目の接種を行うための積極的ワクチン接種
として、未承認製品であるPfizer-BioNTech COVID-19ワクチンの緊急使用を許可するため緊急使用許可(EUA)を発行した。3回目の接種を行うための積極的ワクチン接種
として、未承認製品であるPfizer-BioNTech COVID-19ワクチンの緊急使用を許可するため緊急使用許可(EUA)を発行した。COMIRNATYは、16歳以上の個人を対象に、
COVID-19予防を目的とする2回接種用ワクチンとして承認されており、12~15歳の個人を対象とする緊急使用及び何らかの免疫低下状態であることが確認された12歳以上
の個人に対する3回目の接種としても許可されている。米FDA承認のCOMIRNATY及びEUAを得たPfizer-BioNTech COVID-19ワクチンは同じ製剤であり、COVID-19ワク
チン接種のシリーズを提供する上で相互に使用可能である。
Warnings
Myocarditis and Pericarditis
市販後データにより、特に2回目接種後7日以内の心筋炎及び心膜炎のリスク増加が示されている。観察されたリスクは40歳以下の男性のほうが女性やより高齢の男性より
も高い。観察されたリスクは12~17歳の男性で最も高い。集中治療によるサポートを要した症例もあるが、短期追跡調査から入手されたデータにより、ほとんどの個人は従来
型の治療で症状が回復したことが示される。長期的な後遺症の可能性についての情報は現在入手されていない。米国疾病予防管理センター(CDC)は、心筋炎又は心膜炎
コロナウイルス修飾ウリジン の既往を有する個人のワクチン接種についてなど、ワクチン接種後の心筋炎及び心膜炎に関連する考察を発表した。
80 RNAワクチン(SARS-Co 2. FULL EMERGENCY USE AUTHORIZATION (EUA) PRESCRIBING INFORMATION
アメリカ
(改訂内容)
V-2)
5 WARNINGS AND PRECAUTIONS
5.2 Myocarditis and Pericarditis
1と同様の内容
3. VACCINE INFORMATION FACT SHEET FOR RECIPIENTS AND CAREGIVERS ABOUT COMIRNATY (COVID-19 VACCINE, mRNA) AND PFIZERBIONTECH COVID-19 VACCINE TO PREVENT CORONAVIRUS DISEASE 2019 (COVID-19)
(改訂内容)
米FDA承認済みのCOMIRNATYと EUAの下、米FDAが許可したPfizer-BioNTech COVID-19ワクチンは同じ製剤であり、 COVID-19ワクチン接種のシリーズを提供するうえ
で相互に使用可能である。
・16歳以上の個人を対象に、COVID-19予防を目的とする2回接種用ワクチンとして承認されている。
・以下を対象にEUAの下での接種も許可されている:
12~15歳の個人のCOVID-19予防
何らかの免疫低下状態であることが確認された12歳以上の個人に対する3回目接種
Pfizer-BioNTech COVID-19ワクチンは以下について米FDAからEUAを得ている:
・12歳以上の個人のCOVID-19予防
・何らかの免疫低下状態であることが確認された12歳以上の個人に対する3回目接種
添付文書改訂(警告・禁忌)
注目
82 ブレオマイシン塩酸塩
米国において、特定のロットが回収された。
アメリカ
回収
対応不要
83 シクロスポリン
【第1報】
シンガポールにおいて、シクロスポリン点眼剤の1ロットが回収された。
【第2報】
英国でも同様に点眼剤2ロットが回収された。
【第3報】
仏国でも同様に点眼剤6ロットが回収された。
シンガポール、
フランス、
イギリス
回収
対応不要
84 ミノサイクリン塩酸塩
【第1報】
豪TGAは、ミノサイクリンに関する医療従事者向けの情報提供を行っている。主な内容は以下のとおり。
・製品情報に無顆粒球症に関する情報を追加する改訂作業中である。
・処方者はミノサイクリンに関連する無顆粒球症の潜在的リスク、早期発見及び治療中の全血球数及び肝機能検査のモニタリングの重要性を認識すべきであ
オーストラリア
る。
・ミノサイクリンによる治療を開始する前に、患者は徴候や症状などのリスク、無顆粒球症が疑われる場合の対処法について知っておくべきである。
【第2報】
措置内容に変更なし。企業の見解が報告された。
情報提供
対応済
情報提供
対応不要
局所進行又は転移性尿路上皮癌を有するPD-L1発現陽性のシスプラチン不適格患者及びPD-L1発現の有無を問わないプラチナ製剤併用化学療法不適格患
者を対象とした、レンバチニブメシル酸塩の併用又は非併用下で1次治療としてペムブロリズマブ(遺伝子組換え)を投与する国際共同第Ⅲ相試験において、治
ペムブロリズマブ(遺伝子組 験医師宛にレターが発出された。主な内容は以下のとおり。
86 換え)
アメリカ
・有効性の中間解析において、併用投与の有効性が仮説ほど高くないことが示唆された。
レンバチニブメシル酸塩
・併用投与群では重症(グレード3~5)な有害事象の発現割合が高いことが示された。なお、新たな安全性のシグナルは認められなかった。
・当該試験への新規組入れを中止すること。
・治験薬投与中のすべての被験者において、レンバチニブ又はプラセボの投与を中止すること。
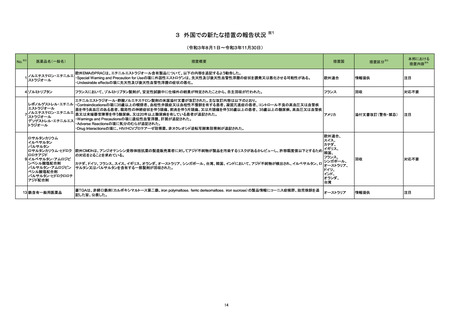
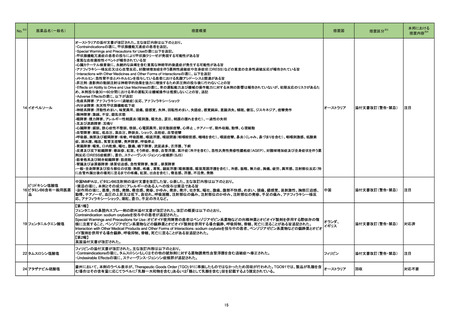
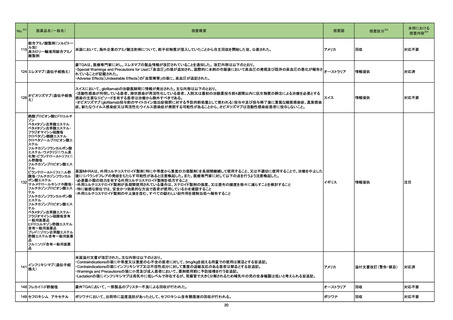
18
No.
医薬品名(一般名)
措置概要
※3
措置国
措置区分
本邦における
措置内容※4
米国において本ワクチンの安全性情報に関する以下のドキュメントが改訂された。
1.FACT SHEET FOR HEALTHCARE PROVIDERS ADMINISTERING VACCINE(VACCINATION PROVIDERS)
EMERGENCY USE AUTHORIZATION(EUA) OF THE PFIZER-BIONTECH COVID-19 VACCINE TO PREVENT CORONAVIRUS DISEASE 2019(COVID-19)
(改訂内容)
米FDAは、12歳以上の個人を対象とするCOVID-19予防と何らかの免疫低下状態であることが確認された12歳以上の個人に3回目の接種を行うための積極的ワクチン接種
として、未承認製品であるPfizer-BioNTech COVID-19ワクチンの緊急使用を許可するため緊急使用許可(EUA)を発行した。3回目の接種を行うための積極的ワクチン接種
として、未承認製品であるPfizer-BioNTech COVID-19ワクチンの緊急使用を許可するため緊急使用許可(EUA)を発行した。COMIRNATYは、16歳以上の個人を対象に、
COVID-19予防を目的とする2回接種用ワクチンとして承認されており、12~15歳の個人を対象とする緊急使用及び何らかの免疫低下状態であることが確認された12歳以上
の個人に対する3回目の接種としても許可されている。米FDA承認のCOMIRNATY及びEUAを得たPfizer-BioNTech COVID-19ワクチンは同じ製剤であり、COVID-19ワク
チン接種のシリーズを提供する上で相互に使用可能である。
Warnings
Myocarditis and Pericarditis
市販後データにより、特に2回目接種後7日以内の心筋炎及び心膜炎のリスク増加が示されている。観察されたリスクは40歳以下の男性のほうが女性やより高齢の男性より
も高い。観察されたリスクは12~17歳の男性で最も高い。集中治療によるサポートを要した症例もあるが、短期追跡調査から入手されたデータにより、ほとんどの個人は従来
型の治療で症状が回復したことが示される。長期的な後遺症の可能性についての情報は現在入手されていない。米国疾病予防管理センター(CDC)は、心筋炎又は心膜炎
コロナウイルス修飾ウリジン の既往を有する個人のワクチン接種についてなど、ワクチン接種後の心筋炎及び心膜炎に関連する考察を発表した。
80 RNAワクチン(SARS-Co 2. FULL EMERGENCY USE AUTHORIZATION (EUA) PRESCRIBING INFORMATION
アメリカ
(改訂内容)
V-2)
5 WARNINGS AND PRECAUTIONS
5.2 Myocarditis and Pericarditis
1と同様の内容
3. VACCINE INFORMATION FACT SHEET FOR RECIPIENTS AND CAREGIVERS ABOUT COMIRNATY (COVID-19 VACCINE, mRNA) AND PFIZERBIONTECH COVID-19 VACCINE TO PREVENT CORONAVIRUS DISEASE 2019 (COVID-19)
(改訂内容)
米FDA承認済みのCOMIRNATYと EUAの下、米FDAが許可したPfizer-BioNTech COVID-19ワクチンは同じ製剤であり、 COVID-19ワクチン接種のシリーズを提供するうえ
で相互に使用可能である。
・16歳以上の個人を対象に、COVID-19予防を目的とする2回接種用ワクチンとして承認されている。
・以下を対象にEUAの下での接種も許可されている:
12~15歳の個人のCOVID-19予防
何らかの免疫低下状態であることが確認された12歳以上の個人に対する3回目接種
Pfizer-BioNTech COVID-19ワクチンは以下について米FDAからEUAを得ている:
・12歳以上の個人のCOVID-19予防
・何らかの免疫低下状態であることが確認された12歳以上の個人に対する3回目接種
添付文書改訂(警告・禁忌)
注目
82 ブレオマイシン塩酸塩
米国において、特定のロットが回収された。
アメリカ
回収
対応不要
83 シクロスポリン
【第1報】
シンガポールにおいて、シクロスポリン点眼剤の1ロットが回収された。
【第2報】
英国でも同様に点眼剤2ロットが回収された。
【第3報】
仏国でも同様に点眼剤6ロットが回収された。
シンガポール、
フランス、
イギリス
回収
対応不要
84 ミノサイクリン塩酸塩
【第1報】
豪TGAは、ミノサイクリンに関する医療従事者向けの情報提供を行っている。主な内容は以下のとおり。
・製品情報に無顆粒球症に関する情報を追加する改訂作業中である。
・処方者はミノサイクリンに関連する無顆粒球症の潜在的リスク、早期発見及び治療中の全血球数及び肝機能検査のモニタリングの重要性を認識すべきであ
オーストラリア
る。
・ミノサイクリンによる治療を開始する前に、患者は徴候や症状などのリスク、無顆粒球症が疑われる場合の対処法について知っておくべきである。
【第2報】
措置内容に変更なし。企業の見解が報告された。
情報提供
対応済
情報提供
対応不要
局所進行又は転移性尿路上皮癌を有するPD-L1発現陽性のシスプラチン不適格患者及びPD-L1発現の有無を問わないプラチナ製剤併用化学療法不適格患
者を対象とした、レンバチニブメシル酸塩の併用又は非併用下で1次治療としてペムブロリズマブ(遺伝子組換え)を投与する国際共同第Ⅲ相試験において、治
ペムブロリズマブ(遺伝子組 験医師宛にレターが発出された。主な内容は以下のとおり。
86 換え)
アメリカ
・有効性の中間解析において、併用投与の有効性が仮説ほど高くないことが示唆された。
レンバチニブメシル酸塩
・併用投与群では重症(グレード3~5)な有害事象の発現割合が高いことが示された。なお、新たな安全性のシグナルは認められなかった。
・当該試験への新規組入れを中止すること。
・治験薬投与中のすべての被験者において、レンバチニブ又はプラセボの投与を中止すること。
18