よむ、つかう、まなぶ。
【資料4】医薬・生活衛生局からの定期報告 (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26381.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第8回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
※2
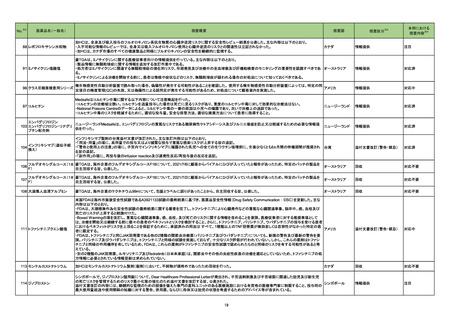
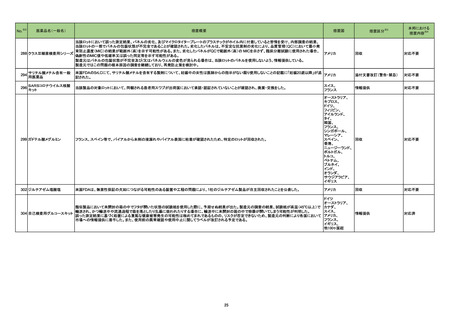
No.
医薬品名(一般名)
措置概要
※3
措置国
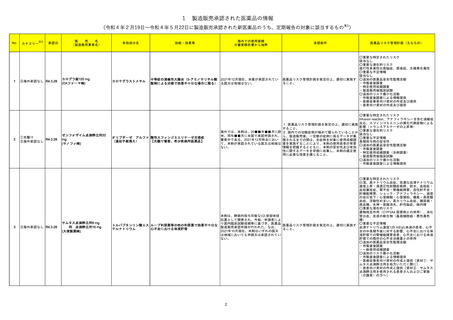
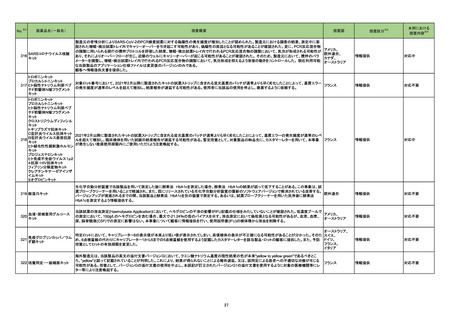
88 レボフロキサシン水和物
加HCは、全身及び吸入投与のフルオロキノロン系抗生物質の心臓弁逆流リスクに関する安全性レビュー結果を公表した。主な内容は以下のとおり。
・入手可能な情報のレビューでは、全身又は吸入フルオロキノロン使用と心臓弁逆流のリスクとの関連性は立証されなかった。
・加HCは、カナダ市場のすべての健康製品と同様にフルオロキノロンの安全性を継続的に監視する。
本邦における
措置内容※4
情報提供
注目
91 ミノサイクリン塩酸塩
豪TGAは、ミノサイクリンに関する医療従事者向けの情報提供を行っている。主な内容は以下のとおり。
・製品情報に無顆粒球症に関する情報を追加する改訂作業中である。
・処方者はミノサイクリンに関連する無顆粒球症の潜在的リスク、早期発見及び治療中の全血球数及び肝機能検査のモニタリングの重要性を認識すべきであ オーストラリア
る。
・ミノサイクリンによる治療を開始する前に、患者は徴候や症状などのリスク、無顆粒球症が疑われる場合の対処法について知っておくべきである。
情報提供
対応済
96 クラスⅢ細菌検査用シリーズ
微生物感受性自動分析装置で読み取った場合、偽陽性が発生する可能性があることを確認した。 使用する微生物感受性自動分析装置によっては、特定の同
アメリカ
定項目の精度管理(QC)の失敗、又は偽陽性による誤同定が発生する可能性があるため、対処法について顧客案内を実施した。
情報提供
対応中
97 コルヒチン
Medsafeはコルヒチン中毒に関する以下内容について注意喚起を行った。
・コルヒチンの治療域は狭い。コルヒチンを過量投与した場合は死亡に至るリスクがあり、重度のコルヒチン中毒に対して効果的な治療法はない。
・National Poisons Centreのデータによると、コルヒチン中毒の一番の原因は小児への曝露であり、次いで治療上の過誤であった。
・コルヒチン中毒のリスクを軽減するために、適切な投与量、安全な保管方法、適切な廃棄方法について患者に指導すること。
ニュージーランド
情報提供
対応済
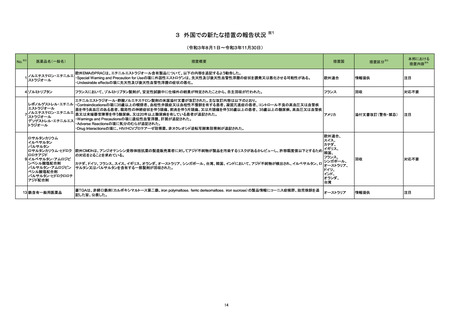
ニュージーランド
情報提供
対応済
添付文書改訂(警告・禁忌)
対応済
エンパグリフロジン
ニュージーランドMedsafeは、エンパグリフロジンの重篤なリスクである糖尿病性ケトアシドーシス及びフルニエ壊疽を防止又は軽減するための必要な情報提
103 エンパグリフロジン・リナグリ
供を行った。
プチン配合剤
インフリキシマブ(遺伝子組
104
換え)
カナダ
措置区分
インフリキシマブ製剤の台湾添付文書が改訂された。主な改訂内容は以下のとおり。
・「用法・用量」の項に、高用量での投与又はより頻繁な投与で重篤な感染リスクが上昇する旨の追記。
・「警告と使用上の注意」の項に、子宮内でインフリキシマブに曝露された乳児への全ての生ワクチン接種前に、生後少なくとも6ヵ月間の待機期間が推奨され 台湾
る旨の追記。
・「副作用」の項に、再投与後のinfusion reaction及び遅発性反応/再投与後の反応を追記。
106
フルデオキシグルコース(18 豪TGAは、海外企業のフルデオキシグルコースF18について、2021/7/6に顧客からバイアルにひびが入っていたと報告があったため、特定のバッチの製品を
F)
自主回収する旨、公表した。
オーストラリア
回収
対応不要
107
フルデオキシグルコース(18 豪TGAは、海外企業のフルデオキシグルコースF18について、2021/7/2に顧客からバイアルにひびが入っていたと報告があったため、特定のバッチの製品を
F)
自主回収する旨、公表した。
オーストラリア
回収
対応不要
オーストラリア
回収
対応不要
108 大凝集人血清アルブミン
豪TGAは、海外企業のテクネチウム99mについて、包装とラベルに誤りがあったことから、自主回収する旨、公表した。
111 トファシチニブクエン酸塩
米国FDAは海外市販後安全性試験であるA3921133試験の最終結果に基づき、医薬品安全性情報(Drug Safety Communication : DSC)を更新した。主な
内容は以下のとおり。
・FDAは、大規模無作為化安全性試験の最終結果に関する審査を完了し、トファシチニブにより心臓発作などの重篤な心臓関連事象、脳卒中、癌、血栓及び
死亡のリスクが上昇すると結論付けた。
・Boxed Warningの項を改訂し、重篤な心臓関連事象、癌、血栓、及び死亡のリスクに関する情報を含めることを要請。医療従事者に対する推奨事項として
は、治療を開始又は継続する前に個々の患者のベネフィットとリスクを検討すること、さらに、トファシチニブ、バリシチニブ、ウパダシチニブの投与を受ける患者
におけるベネフィットがリスクを上回ることを保証するために、承認済みの用法は すべて、1種類以上のTNF阻害薬が無効若しくは忍容性がなかった特定の患
アメリカ
者に限定する。
・FDAは、トファシチニブと同じJAK阻害薬である他の2種類の関節炎治療薬(バリシチニブ及びウパダシチニブ)についても、新規の警告及び最新の警告を要
請。バリシチニブ及びウパダシチニブは、トファシチニブと同様の試験を実施しておらず、十分なリスク評価が行われていない。しかし、これらの薬剤はトファシ
チニブと同様の作用機序を有しているため、FDAは、これらの薬剤がトファシチニブの安全性試験で認められたものと同様のリスクを有する可能性があると考
えている。
・別の2種類のJAK阻害薬、ルキソリチニブ及びfedratinib(日本未承認)は、関節炎やその他の炎症性疾患の治療を適応としていないため、トファシチニブの処
方情報に必要とされている情報更新は求められていない。
添付文書改訂(警告・禁忌)
対応中
113 モンテルカストナトリウム
加HCはモンテルカストナトリウム製剤(錠剤)において、不純物が規格外であったため回収を行った。
回収
対応不要
114 ジノプロストン
シンガポールで、ジノプロストン腟用錠について、Dear Healthcare Professional Letterが発出され、子宮過剰刺激及び子宮破裂に関連した胎児及び新生児
の死亡リスクを管理するためのリスク最小化策の強化のため添付文書を改訂する旨、公表された。
シンガポール
添付文書改訂の内容には、継続的な監視のための設備を備えた専門の産科ユニットのある医療施設における有資格の医療専門家に制限すること、投与時の
最大使用量超過や使用間隔の短縮に対する警告、併用薬、ならびに母体又は胎児の状態を考慮するためのアドバイス等が含まれている。
情報提供
注目
19
カナダ
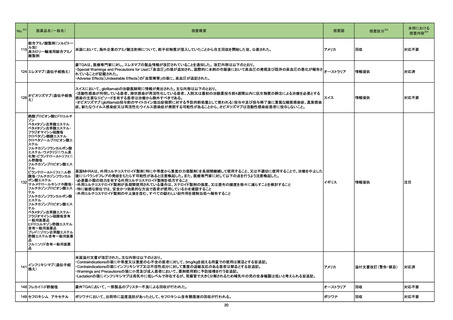
No.
医薬品名(一般名)
措置概要
※3
措置国
88 レボフロキサシン水和物
加HCは、全身及び吸入投与のフルオロキノロン系抗生物質の心臓弁逆流リスクに関する安全性レビュー結果を公表した。主な内容は以下のとおり。
・入手可能な情報のレビューでは、全身又は吸入フルオロキノロン使用と心臓弁逆流のリスクとの関連性は立証されなかった。
・加HCは、カナダ市場のすべての健康製品と同様にフルオロキノロンの安全性を継続的に監視する。
本邦における
措置内容※4
情報提供
注目
91 ミノサイクリン塩酸塩
豪TGAは、ミノサイクリンに関する医療従事者向けの情報提供を行っている。主な内容は以下のとおり。
・製品情報に無顆粒球症に関する情報を追加する改訂作業中である。
・処方者はミノサイクリンに関連する無顆粒球症の潜在的リスク、早期発見及び治療中の全血球数及び肝機能検査のモニタリングの重要性を認識すべきであ オーストラリア
る。
・ミノサイクリンによる治療を開始する前に、患者は徴候や症状などのリスク、無顆粒球症が疑われる場合の対処法について知っておくべきである。
情報提供
対応済
96 クラスⅢ細菌検査用シリーズ
微生物感受性自動分析装置で読み取った場合、偽陽性が発生する可能性があることを確認した。 使用する微生物感受性自動分析装置によっては、特定の同
アメリカ
定項目の精度管理(QC)の失敗、又は偽陽性による誤同定が発生する可能性があるため、対処法について顧客案内を実施した。
情報提供
対応中
97 コルヒチン
Medsafeはコルヒチン中毒に関する以下内容について注意喚起を行った。
・コルヒチンの治療域は狭い。コルヒチンを過量投与した場合は死亡に至るリスクがあり、重度のコルヒチン中毒に対して効果的な治療法はない。
・National Poisons Centreのデータによると、コルヒチン中毒の一番の原因は小児への曝露であり、次いで治療上の過誤であった。
・コルヒチン中毒のリスクを軽減するために、適切な投与量、安全な保管方法、適切な廃棄方法について患者に指導すること。
ニュージーランド
情報提供
対応済
ニュージーランド
情報提供
対応済
添付文書改訂(警告・禁忌)
対応済
エンパグリフロジン
ニュージーランドMedsafeは、エンパグリフロジンの重篤なリスクである糖尿病性ケトアシドーシス及びフルニエ壊疽を防止又は軽減するための必要な情報提
103 エンパグリフロジン・リナグリ
供を行った。
プチン配合剤
インフリキシマブ(遺伝子組
104
換え)
カナダ
措置区分
インフリキシマブ製剤の台湾添付文書が改訂された。主な改訂内容は以下のとおり。
・「用法・用量」の項に、高用量での投与又はより頻繁な投与で重篤な感染リスクが上昇する旨の追記。
・「警告と使用上の注意」の項に、子宮内でインフリキシマブに曝露された乳児への全ての生ワクチン接種前に、生後少なくとも6ヵ月間の待機期間が推奨され 台湾
る旨の追記。
・「副作用」の項に、再投与後のinfusion reaction及び遅発性反応/再投与後の反応を追記。
106
フルデオキシグルコース(18 豪TGAは、海外企業のフルデオキシグルコースF18について、2021/7/6に顧客からバイアルにひびが入っていたと報告があったため、特定のバッチの製品を
F)
自主回収する旨、公表した。
オーストラリア
回収
対応不要
107
フルデオキシグルコース(18 豪TGAは、海外企業のフルデオキシグルコースF18について、2021/7/2に顧客からバイアルにひびが入っていたと報告があったため、特定のバッチの製品を
F)
自主回収する旨、公表した。
オーストラリア
回収
対応不要
オーストラリア
回収
対応不要
108 大凝集人血清アルブミン
豪TGAは、海外企業のテクネチウム99mについて、包装とラベルに誤りがあったことから、自主回収する旨、公表した。
111 トファシチニブクエン酸塩
米国FDAは海外市販後安全性試験であるA3921133試験の最終結果に基づき、医薬品安全性情報(Drug Safety Communication : DSC)を更新した。主な
内容は以下のとおり。
・FDAは、大規模無作為化安全性試験の最終結果に関する審査を完了し、トファシチニブにより心臓発作などの重篤な心臓関連事象、脳卒中、癌、血栓及び
死亡のリスクが上昇すると結論付けた。
・Boxed Warningの項を改訂し、重篤な心臓関連事象、癌、血栓、及び死亡のリスクに関する情報を含めることを要請。医療従事者に対する推奨事項として
は、治療を開始又は継続する前に個々の患者のベネフィットとリスクを検討すること、さらに、トファシチニブ、バリシチニブ、ウパダシチニブの投与を受ける患者
におけるベネフィットがリスクを上回ることを保証するために、承認済みの用法は すべて、1種類以上のTNF阻害薬が無効若しくは忍容性がなかった特定の患
アメリカ
者に限定する。
・FDAは、トファシチニブと同じJAK阻害薬である他の2種類の関節炎治療薬(バリシチニブ及びウパダシチニブ)についても、新規の警告及び最新の警告を要
請。バリシチニブ及びウパダシチニブは、トファシチニブと同様の試験を実施しておらず、十分なリスク評価が行われていない。しかし、これらの薬剤はトファシ
チニブと同様の作用機序を有しているため、FDAは、これらの薬剤がトファシチニブの安全性試験で認められたものと同様のリスクを有する可能性があると考
えている。
・別の2種類のJAK阻害薬、ルキソリチニブ及びfedratinib(日本未承認)は、関節炎やその他の炎症性疾患の治療を適応としていないため、トファシチニブの処
方情報に必要とされている情報更新は求められていない。
添付文書改訂(警告・禁忌)
対応中
113 モンテルカストナトリウム
加HCはモンテルカストナトリウム製剤(錠剤)において、不純物が規格外であったため回収を行った。
回収
対応不要
114 ジノプロストン
シンガポールで、ジノプロストン腟用錠について、Dear Healthcare Professional Letterが発出され、子宮過剰刺激及び子宮破裂に関連した胎児及び新生児
の死亡リスクを管理するためのリスク最小化策の強化のため添付文書を改訂する旨、公表された。
シンガポール
添付文書改訂の内容には、継続的な監視のための設備を備えた専門の産科ユニットのある医療施設における有資格の医療専門家に制限すること、投与時の
最大使用量超過や使用間隔の短縮に対する警告、併用薬、ならびに母体又は胎児の状態を考慮するためのアドバイス等が含まれている。
情報提供
注目
19
カナダ