よむ、つかう、まなぶ。
参考資料2-1 令和3年度厚生労働科学研究費補助金(政策科学総合研究事業臨床研究等ICT 基盤構築・人工知能実装研究事業)AI を活用した医療機器の開発・研究におけるデータ利用の実態把握と課題抽出に資する研究(21AC0701)研究班における検討結果(概要) (15 ページ)
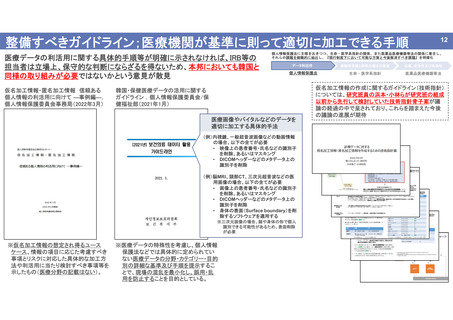
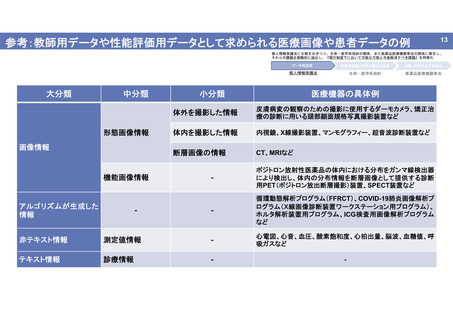
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26018.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会 遺伝子治療等臨床研究における個人情報の取扱いの在り方に関する専門委員会(第7回 6/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
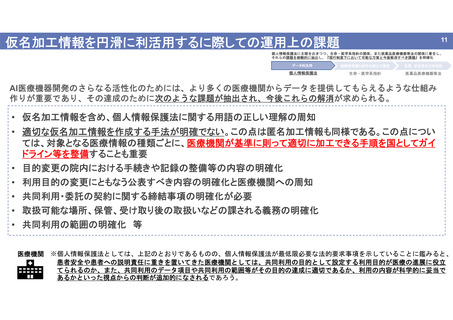
仮名加工情報の利活用;医薬品医療機器等法における関係
15
個人情報保護法に主眼をおきつつ、生命・医学系指針の関係、また医薬品医療機器等法の関係に着目し、
それらの課題を俯瞰的に抽出し、『現行制度下において可能な方策と今後解消すべき課題』を明確化
データ利活用
被験者保護と研究の適正な推進
品質、安全性及び有効性
個人情報保護法
生命・医学系指針
医薬品医療機器等法
【医療機器等の開発から市販までの流れ】
研究開発
非臨床試験
臨床試験
(治験)
本検討班では、医薬品医療
機器等法のもとでの
• 性能評価
• 信頼性調査
審査
医療機器等の開発から市販までの
流れの中でPMDAが関与する箇所
• 市販後学習への仮名加工
情報の利活用
について検討
承認申請
申請書
GLP調査
GCP調査
市販
承認審査業務
STED
申請者が提出した申請資料(試験成績
等) に基づき、性能や安全性を評価。
申請者が提出した申請資料(試
験成績等)の信頼性を調査。
信頼性保証業務
(Good Laboratory Practice)(Good Clinical Practice)
承認
信頼性調査
GPSP調査
(Good Post-Marketing Study)
③ データの信頼性を確保するための基準である
申請資料の信頼性の基準(規則第114条の22)
・ 正確性
・ 網羅性
・ 保存性
② 承認申請に使用される臨床試験(治験) に関する基準である「医療機器
の臨床試験の実施の基準」(平成17年厚生労働省令第36号)=GCP基準
① 非臨床試験のうち、ISO10993/JIS T 0993-1に基づく生物学的試験に関する基準である「医療
機器の安全性に関する非臨床試験の実施の基準」(平成17年厚生労働省令第37号)=GLP基準
15
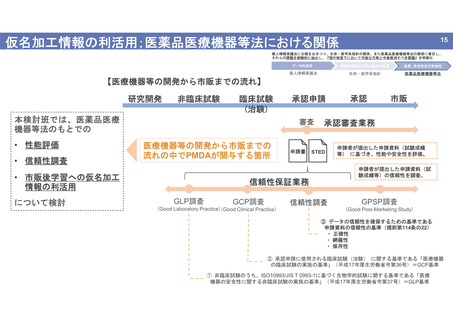
個人情報保護法に主眼をおきつつ、生命・医学系指針の関係、また医薬品医療機器等法の関係に着目し、
それらの課題を俯瞰的に抽出し、『現行制度下において可能な方策と今後解消すべき課題』を明確化
データ利活用
被験者保護と研究の適正な推進
品質、安全性及び有効性
個人情報保護法
生命・医学系指針
医薬品医療機器等法
【医療機器等の開発から市販までの流れ】
研究開発
非臨床試験
臨床試験
(治験)
本検討班では、医薬品医療
機器等法のもとでの
• 性能評価
• 信頼性調査
審査
医療機器等の開発から市販までの
流れの中でPMDAが関与する箇所
• 市販後学習への仮名加工
情報の利活用
について検討
承認申請
申請書
GLP調査
GCP調査
市販
承認審査業務
STED
申請者が提出した申請資料(試験成績
等) に基づき、性能や安全性を評価。
申請者が提出した申請資料(試
験成績等)の信頼性を調査。
信頼性保証業務
(Good Laboratory Practice)(Good Clinical Practice)
承認
信頼性調査
GPSP調査
(Good Post-Marketing Study)
③ データの信頼性を確保するための基準である
申請資料の信頼性の基準(規則第114条の22)
・ 正確性
・ 網羅性
・ 保存性
② 承認申請に使用される臨床試験(治験) に関する基準である「医療機器
の臨床試験の実施の基準」(平成17年厚生労働省令第36号)=GCP基準
① 非臨床試験のうち、ISO10993/JIS T 0993-1に基づく生物学的試験に関する基準である「医療
機器の安全性に関する非臨床試験の実施の基準」(平成17年厚生労働省令第37号)=GLP基準