よむ、つかう、まなぶ。
技-1-2参考 LDTs の臨床実装に係る精度管理の基準等について(通知) (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_68611.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和7年度第2回 1/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
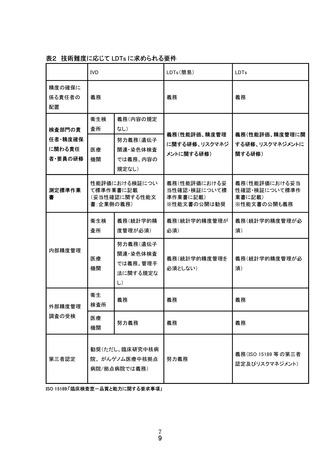
いて標準作業書に可能な限り記載する必要がある
・測定性能評価に関する性能文書6については公開する必要がある
内部精度管理
検査内容に応じた適切な統計学的内部精度管理の定期的実施
統計学的精度管理台帳の作成
外部精度管理調査の受検
大規模サーベイの代替法として以下のような方法がある。
推奨度 B:クロスチェック(検査施設間での盲試料の交換)
直交法(異なる方法(検査室)での比較)
推奨度 C:盲試料の反復検査、認証標準物質、過去に検査した試料の測定
第三者認定
第三者認定は、LDTs の品質確認プロセス及び管理体制等の基本となる要
件を満たす基準として、組織要件(責任体制)である開発・製造主体の責任
についての信頼性を客観的に評価するために必要である。
・品質確認プロセス及び管理体制等の信頼性の客観的な評価は、ISO
15189 認定、CAP 認定を想定している。
・リスクマネジメントに関しては、ISO 15189 と ISO 22367 参照による自己適
合性評価(自己認証)とその公表が想定される。
<LDTs に求められる要件>
LDTs には、高度技術を用いる技術難度の高い検査も含まれる。これらについては
リスクマネジメントや検査試薬・装置要件である製品の品質・性能、製造・品質管理体
制の適正性においての信頼性の客観的な評価の観点から追加の要件が必要である。
現状における LDTs と IVD のギャップを埋めるために必要となる要求事項(表2)を
まとめた。
6
性能文書は、IVD の添付文書において公開が求められる内容(性能等)に準拠し、また
医療法等の一部改正における厚生労働省医政局通知(平成 30 年 8 月 10 日)に明示された
測定標準作業書の記載事項に基づき、
・臨床的意義(検査の目的・対象、LDTs としての必要性、臨床的性能(該当の場合)
等)
・測定方法および測定原理
・性能(正確性、精度、分析感度、分析特異性、検査の変動要因(干渉等)等)
・測定結果の判定法(判定基準、検査の限界等)
・参考文献(該当の場合)
について、当該診療を行う医療機関のウェブサイトに公開すること。
5
7
・測定性能評価に関する性能文書6については公開する必要がある
内部精度管理
検査内容に応じた適切な統計学的内部精度管理の定期的実施
統計学的精度管理台帳の作成
外部精度管理調査の受検
大規模サーベイの代替法として以下のような方法がある。
推奨度 B:クロスチェック(検査施設間での盲試料の交換)
直交法(異なる方法(検査室)での比較)
推奨度 C:盲試料の反復検査、認証標準物質、過去に検査した試料の測定
第三者認定
第三者認定は、LDTs の品質確認プロセス及び管理体制等の基本となる要
件を満たす基準として、組織要件(責任体制)である開発・製造主体の責任
についての信頼性を客観的に評価するために必要である。
・品質確認プロセス及び管理体制等の信頼性の客観的な評価は、ISO
15189 認定、CAP 認定を想定している。
・リスクマネジメントに関しては、ISO 15189 と ISO 22367 参照による自己適
合性評価(自己認証)とその公表が想定される。
<LDTs に求められる要件>
LDTs には、高度技術を用いる技術難度の高い検査も含まれる。これらについては
リスクマネジメントや検査試薬・装置要件である製品の品質・性能、製造・品質管理体
制の適正性においての信頼性の客観的な評価の観点から追加の要件が必要である。
現状における LDTs と IVD のギャップを埋めるために必要となる要求事項(表2)を
まとめた。
6
性能文書は、IVD の添付文書において公開が求められる内容(性能等)に準拠し、また
医療法等の一部改正における厚生労働省医政局通知(平成 30 年 8 月 10 日)に明示された
測定標準作業書の記載事項に基づき、
・臨床的意義(検査の目的・対象、LDTs としての必要性、臨床的性能(該当の場合)
等)
・測定方法および測定原理
・性能(正確性、精度、分析感度、分析特異性、検査の変動要因(干渉等)等)
・測定結果の判定法(判定基準、検査の限界等)
・参考文献(該当の場合)
について、当該診療を行う医療機関のウェブサイトに公開すること。
5
7