よむ、つかう、まなぶ。
技-1-2参考 LDTs の臨床実装に係る精度管理の基準等について(通知) (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_68611.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和7年度第2回 1/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
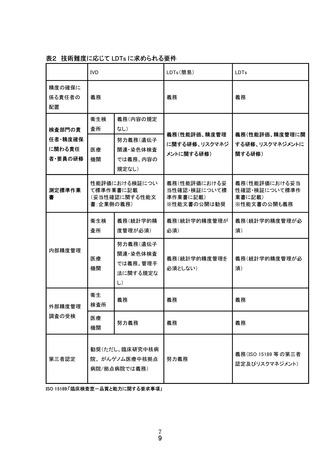
<LDTs が臨床的使用を許容される条件※> ※以下の全てを満たす必要がある。
・臨床的に必要性が高い
・医学的合理性が高い
・IVD が存在しないまたは入手できない
・適時に IVD としての承認が得られない状況にある(上記の4つの要因など)
・検査の精度が保証されている
【検査の品質保証】
<LDTs と IVD の品質確認プロセス及び管理体制等の違い>
IVD を製造販売するためには、大きく3点について規制当局の審査等を受ける必要
がある。すなわち、①製造販売業許可のため企業としての責任体制(市場に流通す
る製品への最終責任、品質保証業務責任、安全管理業務責任を担う能力)の審査、
②製品の品質・性能等の審査等3、③製品の製造・品質管理体制(QMS)の基準4への
適合性にかかる調査である。一方、LDTs には法的根拠に基づく管理・規制体制が存
在しないため、LDTs の運用に関して、IVD と同等の精度を確保するための制度設計
が必要となる。これには、LDTs 提供における組織としての責任体制と製造・品質管理
体制、LDTs の品質・性能等の評価を行うことが妥当と考えられる。検査データの信頼
性は、運用する検査室の能力と検査システムの品質との組み合わせに依存し、その
程度は技術の高度化に比例する。表1に、IVD と LDTs の品質確認プロセス及び管理
体制等の違いについて、組織としての責任体制の組織要件と検査試薬・装置要件に
分けてまとめた。
表1.IVD と LDTsの品質確認プロセス及び管理体制等の要件に係る違い
要件となり得る要素
3
IVD
LDTs(現状)
組織要件
(責任体制)
開発・製造主体の
責任
企業の責任が薬機
法の業許可要件に
より明確化
検査室の自己責任
検査試薬・装置
要件
製品の品質・性能
薬事承認審査等手
続による担保
検査室の自己担保
製造・品質管理体
制の適正性
製造・品質管理の
基準と行政の監視
基準や監視体制が
ない
IVD クラス III・IV の製品については医薬品医療機器総合機構(PMDA)による承認審
査、クラス II の製品については薬機法の登録認証機関による認証審査、クラス I の製品に
ついては製造販売業者による自己適合確認の届出が行われる。
4
「医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令」
3
5
・臨床的に必要性が高い
・医学的合理性が高い
・IVD が存在しないまたは入手できない
・適時に IVD としての承認が得られない状況にある(上記の4つの要因など)
・検査の精度が保証されている
【検査の品質保証】
<LDTs と IVD の品質確認プロセス及び管理体制等の違い>
IVD を製造販売するためには、大きく3点について規制当局の審査等を受ける必要
がある。すなわち、①製造販売業許可のため企業としての責任体制(市場に流通す
る製品への最終責任、品質保証業務責任、安全管理業務責任を担う能力)の審査、
②製品の品質・性能等の審査等3、③製品の製造・品質管理体制(QMS)の基準4への
適合性にかかる調査である。一方、LDTs には法的根拠に基づく管理・規制体制が存
在しないため、LDTs の運用に関して、IVD と同等の精度を確保するための制度設計
が必要となる。これには、LDTs 提供における組織としての責任体制と製造・品質管理
体制、LDTs の品質・性能等の評価を行うことが妥当と考えられる。検査データの信頼
性は、運用する検査室の能力と検査システムの品質との組み合わせに依存し、その
程度は技術の高度化に比例する。表1に、IVD と LDTs の品質確認プロセス及び管理
体制等の違いについて、組織としての責任体制の組織要件と検査試薬・装置要件に
分けてまとめた。
表1.IVD と LDTsの品質確認プロセス及び管理体制等の要件に係る違い
要件となり得る要素
3
IVD
LDTs(現状)
組織要件
(責任体制)
開発・製造主体の
責任
企業の責任が薬機
法の業許可要件に
より明確化
検査室の自己責任
検査試薬・装置
要件
製品の品質・性能
薬事承認審査等手
続による担保
検査室の自己担保
製造・品質管理体
制の適正性
製造・品質管理の
基準と行政の監視
基準や監視体制が
ない
IVD クラス III・IV の製品については医薬品医療機器総合機構(PMDA)による承認審
査、クラス II の製品については薬機法の登録認証機関による認証審査、クラス I の製品に
ついては製造販売業者による自己適合確認の届出が行われる。
4
「医療機器及び体外診断用医薬品の製造管理及び品質管理の基準に関する省令」
3
5