よむ、つかう、まなぶ。
費薬材-1条件及び期限付承認に関する意見 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_65349.html |
| 出典情報 | 中央社会保険医療協議会 費用対効果評価専門部会・薬価専門部会・保険医療材料専門部会 合同部会(第21回 10/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
まとめ
● 条件及び期限付承認制度の重要性や意義を十分に鑑み、製造販売後承認条件評価に対する申請者側の意識を
変えるべく、業界として尽力して参ります
● 条件及び期限付の再生医療等製品の価格算定について
• 製品の多様性を踏まえて、製品毎に必要な一般管理・販売費、営業利益、流通経費を個別に適切に判断し、
算定頂けるようお願いしたい
• 有用性系加算以外の補正加算について、重篤な疾患・希少な疾患に対する製品開発を促進するという主旨に
鑑みて、引き続き条件及び期限付承認時においてご評価頂きたい
● 条件及び期限付の再生医療等製品の本承認時の取扱いについて
• 条件及び期限付承認時には明らかでなかった医療上の有用性が客観的に示された場合、改めて補正加算の該
当性についてご評価頂きたい
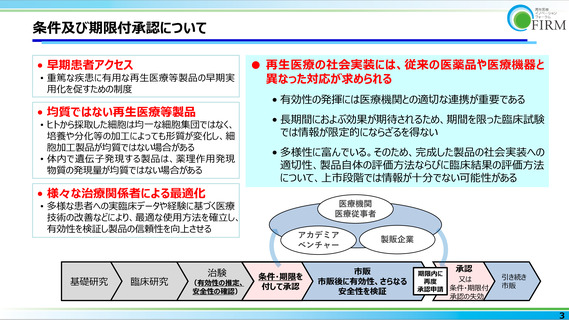
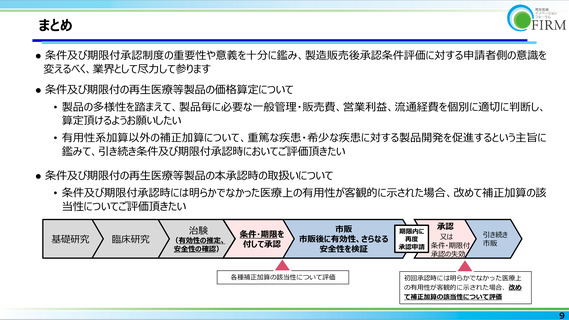
基礎研究
臨床研究
治験
(有効性の推定、
安全性の確認)
条件・期限を
付して承認
市販
市販後に有効性、さらなる
安全性を検証
各種補正加算の該当性について評価
承認
期限内に
又は
再度
承認申請 条件・期限付
引き続き
市販
承認の失効
初回承認時には明らかでなかった医療上
の有用性が客観的に示された場合、改め
て補正加算の該当性について評価
9
● 条件及び期限付承認制度の重要性や意義を十分に鑑み、製造販売後承認条件評価に対する申請者側の意識を
変えるべく、業界として尽力して参ります
● 条件及び期限付の再生医療等製品の価格算定について
• 製品の多様性を踏まえて、製品毎に必要な一般管理・販売費、営業利益、流通経費を個別に適切に判断し、
算定頂けるようお願いしたい
• 有用性系加算以外の補正加算について、重篤な疾患・希少な疾患に対する製品開発を促進するという主旨に
鑑みて、引き続き条件及び期限付承認時においてご評価頂きたい
● 条件及び期限付の再生医療等製品の本承認時の取扱いについて
• 条件及び期限付承認時には明らかでなかった医療上の有用性が客観的に示された場合、改めて補正加算の該
当性についてご評価頂きたい
基礎研究
臨床研究
治験
(有効性の推定、
安全性の確認)
条件・期限を
付して承認
市販
市販後に有効性、さらなる
安全性を検証
各種補正加算の該当性について評価
承認
期限内に
又は
再度
承認申請 条件・期限付
引き続き
市販
承認の失効
初回承認時には明らかでなかった医療上
の有用性が客観的に示された場合、改め
て補正加算の該当性について評価
9