よむ、つかう、まなぶ。
費薬材-1条件及び期限付承認に関する意見 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_65349.html |
| 出典情報 | 中央社会保険医療協議会 費用対効果評価専門部会・薬価専門部会・保険医療材料専門部会 合同部会(第21回 10/29)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
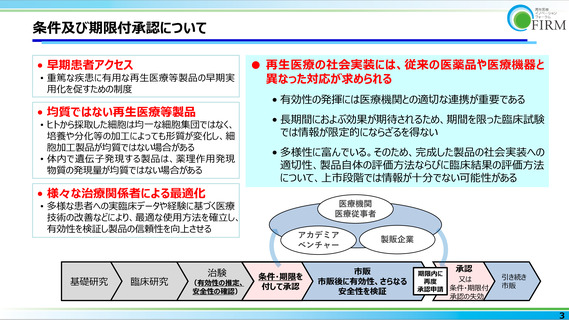
条件及び期限付承認について
• 早期患者アクセス
• 重篤な疾患に有用な再生医療等製品の早期実
用化を促すための制度
• 均質ではない再生医療等製品
• ヒトから採取した細胞は均一な細胞集団ではなく、
培養や分化等の加工によっても形質が変化し、細
胞加工製品が均質ではない場合がある
• 体内で遺伝子発現する製品は、薬理作用発現
物質の発現量が均質ではない場合がある
● 再生医療の社会実装には、従来の医薬品や医療機器と
異なった対応が求められる
• 有効性の発揮には医療機関との適切な連携が重要である
• 長期間におよぶ効果が期待されるため、期間を限った臨床試験
では情報が限定的にならざるを得ない
• 多様性に富んでいる。そのため、完成した製品の社会実装への
適切性、製品自体の評価方法ならびに臨床結果の評価方法
について、上市段階では情報が十分でない可能性がある
• 様々な治療関係者による最適化
• 多様な患者への実臨床データや経験に基づく医療
技術の改善などにより、最適な使用方法を確立し、
有効性を検証し製品の信頼性を向上させる
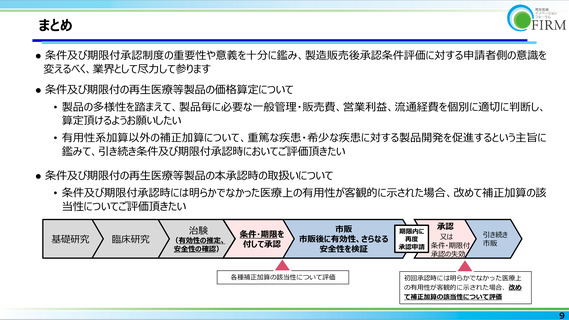
基礎研究
臨床研究
治験
(有効性の推定、
安全性の確認)
医療機関
医療従事者
アカデミア
ベンチャー
条件・期限を
付して承認
製販企業
市販
市販後に有効性、さらなる
安全性を検証
承認
期限内に
又は
再度
承認申請 条件・期限付
引き続き
市販
承認の失効
3
• 早期患者アクセス
• 重篤な疾患に有用な再生医療等製品の早期実
用化を促すための制度
• 均質ではない再生医療等製品
• ヒトから採取した細胞は均一な細胞集団ではなく、
培養や分化等の加工によっても形質が変化し、細
胞加工製品が均質ではない場合がある
• 体内で遺伝子発現する製品は、薬理作用発現
物質の発現量が均質ではない場合がある
● 再生医療の社会実装には、従来の医薬品や医療機器と
異なった対応が求められる
• 有効性の発揮には医療機関との適切な連携が重要である
• 長期間におよぶ効果が期待されるため、期間を限った臨床試験
では情報が限定的にならざるを得ない
• 多様性に富んでいる。そのため、完成した製品の社会実装への
適切性、製品自体の評価方法ならびに臨床結果の評価方法
について、上市段階では情報が十分でない可能性がある
• 様々な治療関係者による最適化
• 多様な患者への実臨床データや経験に基づく医療
技術の改善などにより、最適な使用方法を確立し、
有効性を検証し製品の信頼性を向上させる
基礎研究
臨床研究
治験
(有効性の推定、
安全性の確認)
医療機関
医療従事者
アカデミア
ベンチャー
条件・期限を
付して承認
製販企業
市販
市販後に有効性、さらなる
安全性を検証
承認
期限内に
又は
再度
承認申請 条件・期限付
引き続き
市販
承認の失効
3