よむ、つかう、まなぶ。
資料5-2 PMDAからの調査結果報告[2.8MB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59564.html |
| 出典情報 | 薬事審議会 医療機器・再生医療等製品安全対策部会(令和7年度第1回 7/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
令和7年7月23日
令和7年度第1回医療機器・再生医療等製品安全対策部会
PMDAからの調査結果報告
資料5-2
別紙1
ヒト乾燥硬膜の移植既往のある「脳アミロイド血管症」発症者が報告されたことへの対応について
1.
はじめに
1)品目について
ヒト乾燥硬膜は、主として脳外科手術の際に切除した硬膜を補充するために使用されていた
医療用具であり(表 1)
、日本では、1983 年から 1997 年までの間に 20 万人以上が移植を受け
たと推定されている 1)。1997 年 3 月、ヒト乾燥硬膜移植患者において、伝達性海綿状脳症であ
るクロイツフェルト・ヤコブ病(Creutzfeldt‐Jakob disease:CJD)の発症がみられたという症
例が世界的に 50 例以上報告されたことから、世界保健機関(WHO)の医薬品等に関する伝達
性海綿状脳症専門家会合において、ヒト乾燥硬膜を使用しないようにとの勧告がなされ、日本
においても使用停止及び回収を命じる緊急命令が発出された。
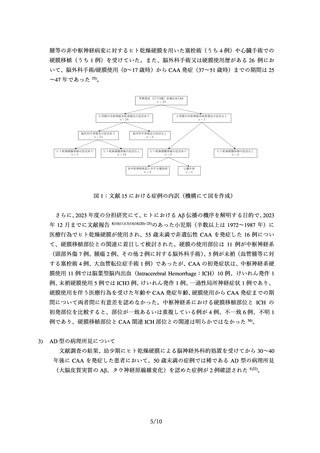
表 1:原材料にヒト乾燥硬膜を使用した医療用具
販売名
輸入販売業者
承認番号(承認日)※
年間販売数(当時)
製造業者名(国名)及
び海外販売名
テュトプラスト デュラ
リオフィライズド・デュラ
日本ビー・エス・エス株式会
株式会社佐多商会
社
48B輸第593号
60B輸第764号
(1973年7月23日)
(1985年8月6日)
約11,000個
約7,000~10,000個
B.braun Melsungen(独国)
LYODURA
Biodynamics International(独国)
Tutoplast Dura
※
旧薬事法下承認
2)脳アミロイド血管症(Cerebral Amyloid Angiopathy:CAA)について
CAA は高齢者やアルツハイマー病(Alzheimer’s disease: AD)の患者においてみられる脳血管
へのアミロイド沈着症である。非遺伝性と遺伝性のものがあり、脳出血や脳梗塞を来す原因の
1 つとして知られている 2)。通常高齢者に見られ、ボストン診断基準(表 2)では possible 及び
probable CAA 関連脳出血の診断基準に 55 歳以上であることが含まれている 3)。近年、幼少期
における頭部外傷や脳外科手術、ヒト乾燥硬膜移植後、30~40 年の潜伏期間を経て医原性脳
アミロイド血管症(iatrogenic Cerebral Amyloid Angiopathy :iCAA)をきたすことが報告されて
いる 4)。2022 年に Gargi Banerjee らにより提案された iCAA の診断基準案(表 3)では発症年齢
が 55 歳未満であること、曝露の可能性がある既往歴としてヒト死体由来中枢神経系組織(脳、
髄膜、下垂体由来ホルモンなど)を使用する処置等又は脳神経外科的処置(脳、脊髄、後眼部
など)が挙げられることが診断基準の 1 つとされている 4)5)。
iCAA は 2015 年のアミロイド β(Aβ)伝播に関する最初の病理学的記述及び 2018 年の実験
的確認を契機に、Aβ seeds 伝播に起因すると認知されるようになった 5)。 iCAA の発症機序は
未だ不明であるものの、ヒト死体由来中枢神経系組織からの Aβ seeds の直接伝播によって引き
令和7年度第1回医療機器・再生医療等製品安全対策部会
PMDAからの調査結果報告
資料5-2
別紙1
ヒト乾燥硬膜の移植既往のある「脳アミロイド血管症」発症者が報告されたことへの対応について
1.
はじめに
1)品目について
ヒト乾燥硬膜は、主として脳外科手術の際に切除した硬膜を補充するために使用されていた
医療用具であり(表 1)
、日本では、1983 年から 1997 年までの間に 20 万人以上が移植を受け
たと推定されている 1)。1997 年 3 月、ヒト乾燥硬膜移植患者において、伝達性海綿状脳症であ
るクロイツフェルト・ヤコブ病(Creutzfeldt‐Jakob disease:CJD)の発症がみられたという症
例が世界的に 50 例以上報告されたことから、世界保健機関(WHO)の医薬品等に関する伝達
性海綿状脳症専門家会合において、ヒト乾燥硬膜を使用しないようにとの勧告がなされ、日本
においても使用停止及び回収を命じる緊急命令が発出された。
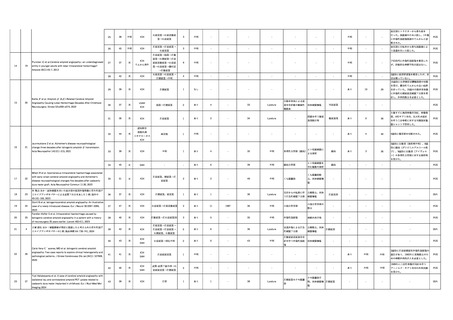
表 1:原材料にヒト乾燥硬膜を使用した医療用具
販売名
輸入販売業者
承認番号(承認日)※
年間販売数(当時)
製造業者名(国名)及
び海外販売名
テュトプラスト デュラ
リオフィライズド・デュラ
日本ビー・エス・エス株式会
株式会社佐多商会
社
48B輸第593号
60B輸第764号
(1973年7月23日)
(1985年8月6日)
約11,000個
約7,000~10,000個
B.braun Melsungen(独国)
LYODURA
Biodynamics International(独国)
Tutoplast Dura
※
旧薬事法下承認
2)脳アミロイド血管症(Cerebral Amyloid Angiopathy:CAA)について
CAA は高齢者やアルツハイマー病(Alzheimer’s disease: AD)の患者においてみられる脳血管
へのアミロイド沈着症である。非遺伝性と遺伝性のものがあり、脳出血や脳梗塞を来す原因の
1 つとして知られている 2)。通常高齢者に見られ、ボストン診断基準(表 2)では possible 及び
probable CAA 関連脳出血の診断基準に 55 歳以上であることが含まれている 3)。近年、幼少期
における頭部外傷や脳外科手術、ヒト乾燥硬膜移植後、30~40 年の潜伏期間を経て医原性脳
アミロイド血管症(iatrogenic Cerebral Amyloid Angiopathy :iCAA)をきたすことが報告されて
いる 4)。2022 年に Gargi Banerjee らにより提案された iCAA の診断基準案(表 3)では発症年齢
が 55 歳未満であること、曝露の可能性がある既往歴としてヒト死体由来中枢神経系組織(脳、
髄膜、下垂体由来ホルモンなど)を使用する処置等又は脳神経外科的処置(脳、脊髄、後眼部
など)が挙げられることが診断基準の 1 つとされている 4)5)。
iCAA は 2015 年のアミロイド β(Aβ)伝播に関する最初の病理学的記述及び 2018 年の実験
的確認を契機に、Aβ seeds 伝播に起因すると認知されるようになった 5)。 iCAA の発症機序は
未だ不明であるものの、ヒト死体由来中枢神経系組織からの Aβ seeds の直接伝播によって引き