よむ、つかう、まなぶ。
薬-3日本製薬工業協会、米国研究製薬工業協会、欧州製薬団体連合会[507KB] (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59378.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第236回 7/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
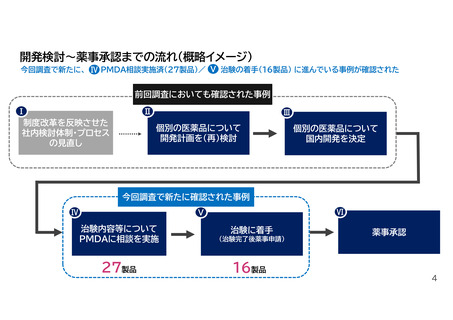
開発検討~薬事承認までの流れ(概略イメージ)
今回調査で新たに、 Ⅳ PMDA相談実施済(27製品)/ Ⅴ 治験の着手(16製品) に進んでいる事例が確認された
前回調査においても確認された事例
Ⅰ
Ⅱ
制度改革を反映させた
社内検討体制・プロセス
の見直し
Ⅲ
個別の医薬品について
開発計画を(再)検討
個別の医薬品について
国内開発を決定
今回調査で新たに確認された事例
Ⅳ
Ⅵ
Ⅴ
治験内容等について
PMDAに相談を実施
(治験完了後薬事申請)
27製品
16製品
治験に着手
薬事承認
4
今回調査で新たに、 Ⅳ PMDA相談実施済(27製品)/ Ⅴ 治験の着手(16製品) に進んでいる事例が確認された
前回調査においても確認された事例
Ⅰ
Ⅱ
制度改革を反映させた
社内検討体制・プロセス
の見直し
Ⅲ
個別の医薬品について
開発計画を(再)検討
個別の医薬品について
国内開発を決定
今回調査で新たに確認された事例
Ⅳ
Ⅵ
Ⅴ
治験内容等について
PMDAに相談を実施
(治験完了後薬事申請)
27製品
16製品
治験に着手
薬事承認
4