よむ、つかう、まなぶ。
薬-3日本製薬工業協会、米国研究製薬工業協会、欧州製薬団体連合会[507KB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59378.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第236回 7/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
エグゼクティブ・サマリー
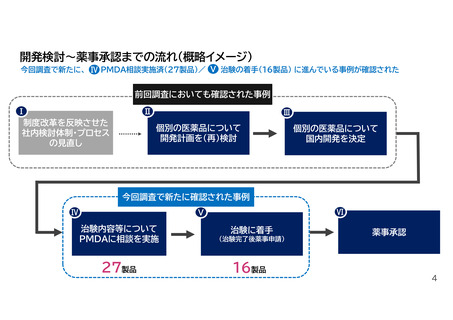
前回調査/今回調査にて確認された事項
前回調査にて確認された事項
今回調査にて新たに確認された事項
(2024年10月実施)
(2025年6月実施)
<2024年12月11日中医協薬価専門部会で報告>
2024年度薬価制度改革によって、以下のよう
な日本国内での開発を推進しようとする意思変
容が起きていることが確認された。
開発計画フェーズ
その後、実際に国内開発を進める行動変容が進
んできていることが確認された。具体的には、
対外的なアクションを伴う以下のような動きの
ある製品が多く出てきている。
(前回調査では、そうした事例の存在は確認されず)
治験実施フェーズ
Ⅰ 社内における開発品目の検討体制やプロ
セスの見直し
Ⅱ 個々の製品の開発計画の再検討
Ⅳ 治験内容等についてPMDAに相談を実施
Ⅴ 治験に着手
Ⅲ 製品の国内開発を決定するに至った
しかしながらこの時点においては、治験実施に
向けてPMDAとの相談をすでに開始していた
り、治験の着手まで至っている製品までは確認
されなかった。
2024年度薬価制度改革によって促進された
国内開発の内容は以下のように大分された。
❶国内での開発時期・申請予定時期の前倒し
❷国内小児開発の新たな開発
❸国内での新たな成分・適応症の開発
3
前回調査/今回調査にて確認された事項
前回調査にて確認された事項
今回調査にて新たに確認された事項
(2024年10月実施)
(2025年6月実施)
<2024年12月11日中医協薬価専門部会で報告>
2024年度薬価制度改革によって、以下のよう
な日本国内での開発を推進しようとする意思変
容が起きていることが確認された。
開発計画フェーズ
その後、実際に国内開発を進める行動変容が進
んできていることが確認された。具体的には、
対外的なアクションを伴う以下のような動きの
ある製品が多く出てきている。
(前回調査では、そうした事例の存在は確認されず)
治験実施フェーズ
Ⅰ 社内における開発品目の検討体制やプロ
セスの見直し
Ⅱ 個々の製品の開発計画の再検討
Ⅳ 治験内容等についてPMDAに相談を実施
Ⅴ 治験に着手
Ⅲ 製品の国内開発を決定するに至った
しかしながらこの時点においては、治験実施に
向けてPMDAとの相談をすでに開始していた
り、治験の着手まで至っている製品までは確認
されなかった。
2024年度薬価制度改革によって促進された
国内開発の内容は以下のように大分された。
❶国内での開発時期・申請予定時期の前倒し
❷国内小児開発の新たな開発
❸国内での新たな成分・適応症の開発
3