よむ、つかう、まなぶ。
薬-3日本製薬工業協会、米国研究製薬工業協会、欧州製薬団体連合会[507KB] (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59378.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第236回 7/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
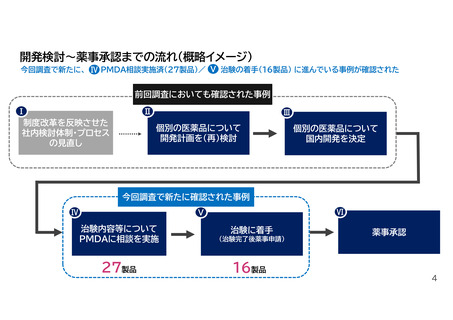
Ⅴ 治験着手にまで至った事例
❸国内での新たな成分・適応症の開発の実施
2024年12月の中医協意見陳述資料p.8(国内開発を決定)で報告した事例
薬事制度改革・薬価制度改革により
希少疾病用医薬品の日本への導入契約締結が
後押しされた事例
☆はP6に記載した事例
2024年12月の中医協意見陳述資料p.8(国内開発を決定)で報告した事例
加算評価の充実により
日本への導入契約締結が後押しされた事例
希少疾病(米国で既に承認済)
がん(米国で既に承認済)
• これまで:日本で開発を実施した場合の期間・費用および
事業性の見極めに時間を要していた
• 変革要因:薬事制度改革(日本人データの必要性の検討)・
希少疾病加算の加算率付与の考え方および新薬創出等加
算の基準改正により、事業性が向上し、導入の意思決定を
後押し
• 現状: 国内承認を得るために必要な追加試験等について
PMDA相談を実施。近日中に治験届提出予定。
• これまで:国内導入を検討するも、補正加算を取得できるか
が不透明で、日本における事業性に懸念
• 変革要因:有用性系加算の定量的評価の項目見直しによっ
て補正加算を得られる可能性が向上し、事業評価がポジ
ティブに転じた
• 現状:国内承認を得るために必要な追加試験等について
PMDA相談を実施。近日中に治験届提出予定。
12
❸国内での新たな成分・適応症の開発の実施
2024年12月の中医協意見陳述資料p.8(国内開発を決定)で報告した事例
薬事制度改革・薬価制度改革により
希少疾病用医薬品の日本への導入契約締結が
後押しされた事例
☆はP6に記載した事例
2024年12月の中医協意見陳述資料p.8(国内開発を決定)で報告した事例
加算評価の充実により
日本への導入契約締結が後押しされた事例
希少疾病(米国で既に承認済)
がん(米国で既に承認済)
• これまで:日本で開発を実施した場合の期間・費用および
事業性の見極めに時間を要していた
• 変革要因:薬事制度改革(日本人データの必要性の検討)・
希少疾病加算の加算率付与の考え方および新薬創出等加
算の基準改正により、事業性が向上し、導入の意思決定を
後押し
• 現状: 国内承認を得るために必要な追加試験等について
PMDA相談を実施。近日中に治験届提出予定。
• これまで:国内導入を検討するも、補正加算を取得できるか
が不透明で、日本における事業性に懸念
• 変革要因:有用性系加算の定量的評価の項目見直しによっ
て補正加算を得られる可能性が向上し、事業評価がポジ
ティブに転じた
• 現状:国内承認を得るために必要な追加試験等について
PMDA相談を実施。近日中に治験届提出予定。
12