よむ、つかう、まなぶ。
薬-3日本製薬工業協会、米国研究製薬工業協会、欧州製薬団体連合会[507KB] (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59378.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第236回 7/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
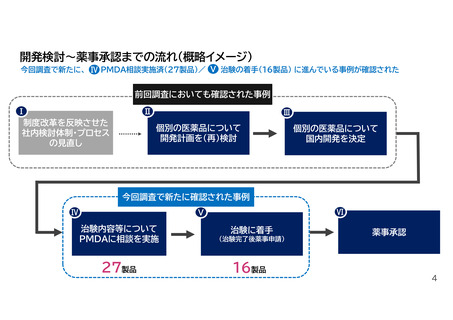
Ⅴ 治験着手にまで至った事例
❸国内での新たな成分・適応症の開発の実施
☆はP6に記載した事例
2024年12月の中医協意見陳述資料p.8(国内開発を決定)で報告した事例
薬事制度改革・薬価制度改革により
☆ 開発元の企業(買収先)において全く検討されていなかった
製品の国内開発の早期意思決定につながった事例
薬事制度改革・薬価制度改革により
希少疾病用医薬品の開発検討が促進された事例
がんなど(4製品)
希少疾病
• これまで:当社が買収を行った企業において日本での
開発はスコープに含まれておらず、買収成立時点にお
いて、これら製品の日本での開発は一切計画されてい
なかった。
• 変革要因:国内開発の可能性を買収後に検討開始して
いた中、①薬事制度改革により国内第1相試験完了を
待たずに第3相試験を実施できるようになったこと、➁
それによって今回の薬価制度改革で創設された迅速導
入加算の適用(それに伴う新薬創出等加算の適用を含
む)が可能となり日本での事業性を期待できるように
なったことが、グローバルのトップマネジメントの意思
決定を後押し
• 現状:国内治験を開始済
• これまで:薬事上の希少疾病用医薬品指定を受けるかどう
かは、開発部門で一義的に判断してきた
• 変革要因:①薬事制度改革において希少疾病用医薬品の指
定基準が変更となり、希少疾病用医薬品の裾野が広がり、
取得の可能性が高まったこと、②薬価制度改革において従
来よりも高い希少疾病に係る加算の加算率が見込めるよ
うになったことから、希少疾病用医薬品の開発を以前より
も積極的に検討するようになった
• 現状:国内治験を開始済
11
❸国内での新たな成分・適応症の開発の実施
☆はP6に記載した事例
2024年12月の中医協意見陳述資料p.8(国内開発を決定)で報告した事例
薬事制度改革・薬価制度改革により
☆ 開発元の企業(買収先)において全く検討されていなかった
製品の国内開発の早期意思決定につながった事例
薬事制度改革・薬価制度改革により
希少疾病用医薬品の開発検討が促進された事例
がんなど(4製品)
希少疾病
• これまで:当社が買収を行った企業において日本での
開発はスコープに含まれておらず、買収成立時点にお
いて、これら製品の日本での開発は一切計画されてい
なかった。
• 変革要因:国内開発の可能性を買収後に検討開始して
いた中、①薬事制度改革により国内第1相試験完了を
待たずに第3相試験を実施できるようになったこと、➁
それによって今回の薬価制度改革で創設された迅速導
入加算の適用(それに伴う新薬創出等加算の適用を含
む)が可能となり日本での事業性を期待できるように
なったことが、グローバルのトップマネジメントの意思
決定を後押し
• 現状:国内治験を開始済
• これまで:薬事上の希少疾病用医薬品指定を受けるかどう
かは、開発部門で一義的に判断してきた
• 変革要因:①薬事制度改革において希少疾病用医薬品の指
定基準が変更となり、希少疾病用医薬品の裾野が広がり、
取得の可能性が高まったこと、②薬価制度改革において従
来よりも高い希少疾病に係る加算の加算率が見込めるよ
うになったことから、希少疾病用医薬品の開発を以前より
も積極的に検討するようになった
• 現状:国内治験を開始済
11