よむ、つかう、まなぶ。
【資料2-2】神経内視鏡承認基準 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58452.html |
| 出典情報 | 薬事審議会 医療機器・体外診断薬部会(令和7年度第2回 6/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
5 表示
5.1 最小限の表示
a) 内視鏡を識別するのに必要な型番及び/又はその他のマーク。
b) 内視鏡の使用目的に必要な場合、
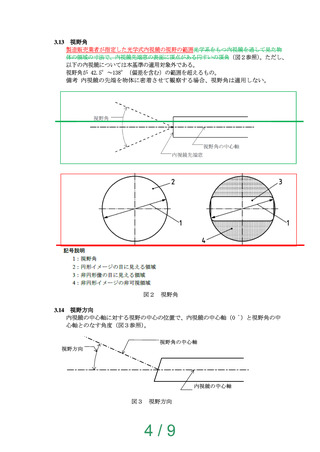
挿入部最大径、チャンネル最小径、有効長、視野角及び/又は視野方向。
挿入部径とチャンネル径の単位は、mm とする。挿入部径とチャンネル径は、3.4
フレンチ(シャリエール)で定義したように、Fr を表示するか、又は数値を丸で
囲み、フレンチサイズで表示してもよい。
6 注意事項等情報(添付文書等)
少なくとも次の情報を含む添付文書等を、使用者に供給しなければならない。
a) 内視鏡の使用目的の記述。
b) 内視鏡並びに組合せ機器の機能、適正な使用法に関する説明および以下に示す記
述。
1) 挿入部最小径 0.945mm 未満の神経内視鏡は、カテーテル等を併用するこ
と。
2) 挿入部最大径 3.04mm を超える神経内視鏡は脳以外には使用しないこと。
c) 注釈付きの内視鏡のイラスト。使用者が内視鏡の関連部位と特徴を識別するのに役立
つような適切なもので、また、
「3 定義」と矛盾しないもの。
d) 次の事項を含む内視鏡の識別並びに仕様事項。
1) 製造販売業者名、及び住所。
2) 内視鏡の型番並びにその名称。
3) 挿入部最大径及び有効長。
4) 視野方向。
5) 使用者が操作できる操作部分及びそれに連動する被制御部分の位置。
6) 使用者が交換可能な部品の明示及びその交換方法の説明。
7) 使用者が内視鏡の製造販売業者が指定した認定サービスを受けられる場所の
明示。
8) 内視鏡のチャンネル最小径。
e) 内視鏡の使用目的に対してその組立てに必要な説明、内視鏡の分解、並びに洗浄、
消毒及び/又は滅菌処理の後の再組立てに必要な説明。
f) この内視鏡と一緒に使用することを意図した電気、電子、電気光学、医用電気又は電
気音響装置に関する事項を含み、「JIS T 0601-2-18」に適合する、内視鏡の使用
目的に対する次の警告及び説明。
1) 内視鏡と一緒に使用する造影剤、硬化治療剤、麻酔薬などの適用可能な液体及び
適用不可能な液体に関する注意事項。
2) 可燃性の環境で使用することへの警告。
g) 内視鏡が正常に作動することの合理的な保証を与える検査方法の説明。
h) 再使用可能な内視鏡の洗浄方法、並びに特別な洗浄用具又は装置の識別。
i) 内視鏡が耐える特別な消毒、滅菌環境及びその耐用回数等についての説明。
j) 使用前の内視鏡の推奨保管方法、並びに再使用可能な内視鏡の使用時と次の使用時と
の間の推奨保管方法
9/9
- 7 -
5.1 最小限の表示
a) 内視鏡を識別するのに必要な型番及び/又はその他のマーク。
b) 内視鏡の使用目的に必要な場合、
挿入部最大径、チャンネル最小径、有効長、視野角及び/又は視野方向。
挿入部径とチャンネル径の単位は、mm とする。挿入部径とチャンネル径は、3.4
フレンチ(シャリエール)で定義したように、Fr を表示するか、又は数値を丸で
囲み、フレンチサイズで表示してもよい。
6 注意事項等情報(添付文書等)
少なくとも次の情報を含む添付文書等を、使用者に供給しなければならない。
a) 内視鏡の使用目的の記述。
b) 内視鏡並びに組合せ機器の機能、適正な使用法に関する説明および以下に示す記
述。
1) 挿入部最小径 0.945mm 未満の神経内視鏡は、カテーテル等を併用するこ
と。
2) 挿入部最大径 3.04mm を超える神経内視鏡は脳以外には使用しないこと。
c) 注釈付きの内視鏡のイラスト。使用者が内視鏡の関連部位と特徴を識別するのに役立
つような適切なもので、また、
「3 定義」と矛盾しないもの。
d) 次の事項を含む内視鏡の識別並びに仕様事項。
1) 製造販売業者名、及び住所。
2) 内視鏡の型番並びにその名称。
3) 挿入部最大径及び有効長。
4) 視野方向。
5) 使用者が操作できる操作部分及びそれに連動する被制御部分の位置。
6) 使用者が交換可能な部品の明示及びその交換方法の説明。
7) 使用者が内視鏡の製造販売業者が指定した認定サービスを受けられる場所の
明示。
8) 内視鏡のチャンネル最小径。
e) 内視鏡の使用目的に対してその組立てに必要な説明、内視鏡の分解、並びに洗浄、
消毒及び/又は滅菌処理の後の再組立てに必要な説明。
f) この内視鏡と一緒に使用することを意図した電気、電子、電気光学、医用電気又は電
気音響装置に関する事項を含み、「JIS T 0601-2-18」に適合する、内視鏡の使用
目的に対する次の警告及び説明。
1) 内視鏡と一緒に使用する造影剤、硬化治療剤、麻酔薬などの適用可能な液体及び
適用不可能な液体に関する注意事項。
2) 可燃性の環境で使用することへの警告。
g) 内視鏡が正常に作動することの合理的な保証を与える検査方法の説明。
h) 再使用可能な内視鏡の洗浄方法、並びに特別な洗浄用具又は装置の識別。
i) 内視鏡が耐える特別な消毒、滅菌環境及びその耐用回数等についての説明。
j) 使用前の内視鏡の推奨保管方法、並びに再使用可能な内視鏡の使用時と次の使用時と
の間の推奨保管方法
9/9
- 7 -