よむ、つかう、まなぶ。
○最適使用推進ガイドラインについて-3-1 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00143.html |
| 出典情報 | 中央社会保険医療協議会 総会(第519回 4/13)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
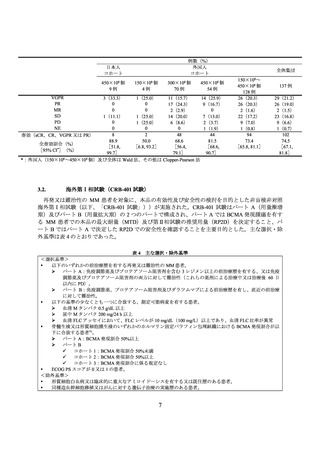
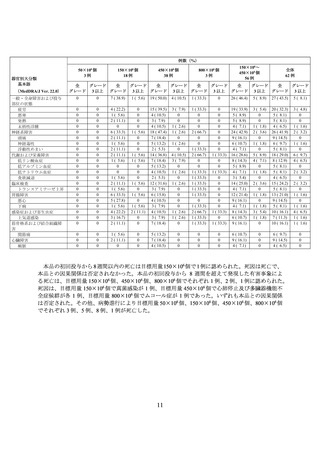
例数(%)
外国人
コホート
日本人
コホート
450×106 個
9例
150×106 個
4例
300×106 個
70 例
VGPR
PR
MR
SD
PD
NE
奏効(sCR、CR、VGPR 又は PR)
450×106 個
54 例
3(33.3)
1(25.0)
11(15.7)
14(25.9)
0
0
17(24.3)
9(16.7)
0
0
0
2(2.9)
1(11.1)
1(25.0)
14(20.0)
7(13.0)
0
1(25.0)
6(8.6)
2(3.7)
0
0
0
1(1.9)
8
2
48
44
88.9
50.0
68.6
81.5
全奏効割合(%)
[51.8,
[6.8, 93.2]
[56.4,
[68.6,
[95% CI*](%)
99.7]
79.1]
90.7]
*:外国人(150×106~450×106 個)及び全体は Wald 法、その他は Clopper-Pearson 法
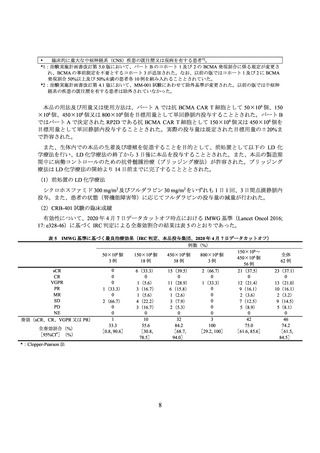
3.2.
全体集団
150×106~
450×106 個
128 例
26(20.3)
26(20.3)
2(1.6)
22(17.2)
9(7.0)
1(0.8)
94
73.4
[65.8, 81.1]
137 例
29(21.2)
26(19.0)
2(1.5)
23(16.8)
9(6.6)
1(0.7)
102
74.5
[67.1,
81.8]
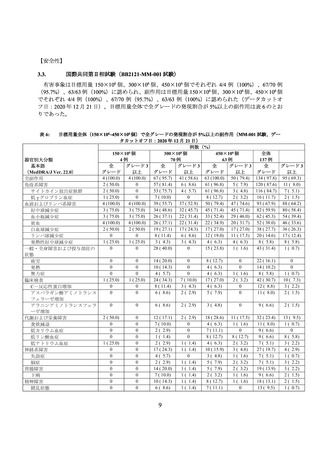
海外第Ⅰ相試験(CRB-401 試験)
再発又は難治性の MM 患者を対象に、本品の有効性及び安全性の検討を目的とした非盲検非対照
海外第Ⅰ相試験(以下、「CRB-401 試験」))が実施された。CRB-401 試験はパート A(用量漸増
期)及びパート B(用量拡大期)の 2 つのパートで構成され、パート A では BCMA 発現腫瘍を有す
る MM 患者での本品の最大耐量(MTD)及び第Ⅱ相試験の推奨用量(RP2D)を決定すること、パ
ート B ではパート A で決定した RP2D での安全性を確認することを主要目的とした。主な選択・除
外基準は表 4 のとおりであった。
表 4 主な選択・除外基準
<選択基準>
以下のいずれかの前治療歴を有する再発又は難治性の MM 患者。
パート A:免疫調節薬及びプロテアソーム阻害剤を含む 3 レジメン以上の前治療歴を有する、又は免疫
調節薬及びプロテアソーム阻害剤の両方に対して難治性(これらの薬剤による治療中又は治療後 60 日
以内に PD)。
パート B:免疫調節薬、プロテアソーム阻害剤及びダラツムマブによる前治療歴を有し、直近の前治療
に対して難治性。
以下の基準の少なくとも一つに合致する、測定可能病変を有する患者。
血清 M タンパク 0.5 g/dL 以上
尿中 M タンパク 200 mg/24 h 以上
血清 FLC アッセイにおいて、FLC レベルが 10 mg/dL(100 mg/L)以上であり、血清 FLC 比率が異常
骨髄生検又は形質細胞腫生検のいずれかのホルマリン固定パラフィン包埋組織における BCMA 発現割合が以
下に合致する患者*1。
パート A:BCMA 発現割合 50%以上
パート B
コホート 1:BCMA 発現割合 50%未満
コホート 2:BCMA 発現割合 50%以上
コホート 3:BCMA 発現割合に係る規定なし
ECOG PS スコアが 0 又は 1 の患者。
<除外基準>
形質細胞白血病又は臨床的に重大なアミロイドーシスを有する又は既往歴のある患者。
同種造血幹細胞移植又はがんに対する遺伝子治療の実施歴のある患者。
7
外国人
コホート
日本人
コホート
450×106 個
9例
150×106 個
4例
300×106 個
70 例
VGPR
PR
MR
SD
PD
NE
奏効(sCR、CR、VGPR 又は PR)
450×106 個
54 例
3(33.3)
1(25.0)
11(15.7)
14(25.9)
0
0
17(24.3)
9(16.7)
0
0
0
2(2.9)
1(11.1)
1(25.0)
14(20.0)
7(13.0)
0
1(25.0)
6(8.6)
2(3.7)
0
0
0
1(1.9)
8
2
48
44
88.9
50.0
68.6
81.5
全奏効割合(%)
[51.8,
[6.8, 93.2]
[56.4,
[68.6,
[95% CI*](%)
99.7]
79.1]
90.7]
*:外国人(150×106~450×106 個)及び全体は Wald 法、その他は Clopper-Pearson 法
3.2.
全体集団
150×106~
450×106 個
128 例
26(20.3)
26(20.3)
2(1.6)
22(17.2)
9(7.0)
1(0.8)
94
73.4
[65.8, 81.1]
137 例
29(21.2)
26(19.0)
2(1.5)
23(16.8)
9(6.6)
1(0.7)
102
74.5
[67.1,
81.8]
海外第Ⅰ相試験(CRB-401 試験)
再発又は難治性の MM 患者を対象に、本品の有効性及び安全性の検討を目的とした非盲検非対照
海外第Ⅰ相試験(以下、「CRB-401 試験」))が実施された。CRB-401 試験はパート A(用量漸増
期)及びパート B(用量拡大期)の 2 つのパートで構成され、パート A では BCMA 発現腫瘍を有す
る MM 患者での本品の最大耐量(MTD)及び第Ⅱ相試験の推奨用量(RP2D)を決定すること、パ
ート B ではパート A で決定した RP2D での安全性を確認することを主要目的とした。主な選択・除
外基準は表 4 のとおりであった。
表 4 主な選択・除外基準
<選択基準>
以下のいずれかの前治療歴を有する再発又は難治性の MM 患者。
パート A:免疫調節薬及びプロテアソーム阻害剤を含む 3 レジメン以上の前治療歴を有する、又は免疫
調節薬及びプロテアソーム阻害剤の両方に対して難治性(これらの薬剤による治療中又は治療後 60 日
以内に PD)。
パート B:免疫調節薬、プロテアソーム阻害剤及びダラツムマブによる前治療歴を有し、直近の前治療
に対して難治性。
以下の基準の少なくとも一つに合致する、測定可能病変を有する患者。
血清 M タンパク 0.5 g/dL 以上
尿中 M タンパク 200 mg/24 h 以上
血清 FLC アッセイにおいて、FLC レベルが 10 mg/dL(100 mg/L)以上であり、血清 FLC 比率が異常
骨髄生検又は形質細胞腫生検のいずれかのホルマリン固定パラフィン包埋組織における BCMA 発現割合が以
下に合致する患者*1。
パート A:BCMA 発現割合 50%以上
パート B
コホート 1:BCMA 発現割合 50%未満
コホート 2:BCMA 発現割合 50%以上
コホート 3:BCMA 発現割合に係る規定なし
ECOG PS スコアが 0 又は 1 の患者。
<除外基準>
形質細胞白血病又は臨床的に重大なアミロイドーシスを有する又は既往歴のある患者。
同種造血幹細胞移植又はがんに対する遺伝子治療の実施歴のある患者。
7