よむ、つかう、まなぶ。
【資料1-2】前回の制度改正における見直し事項の対応状況について(参考資料) (25 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_39786.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第1回 4/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
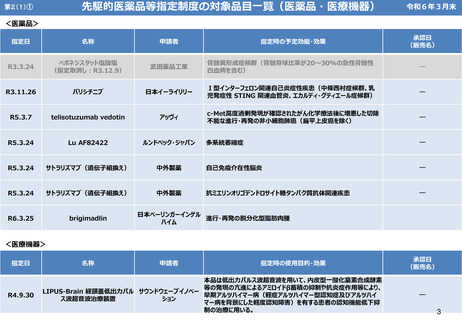
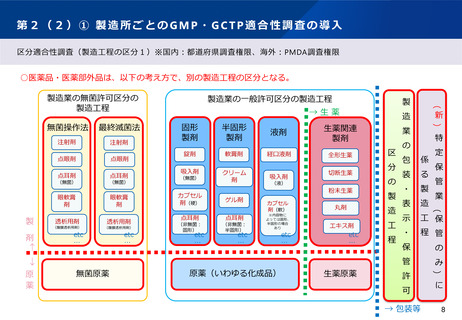
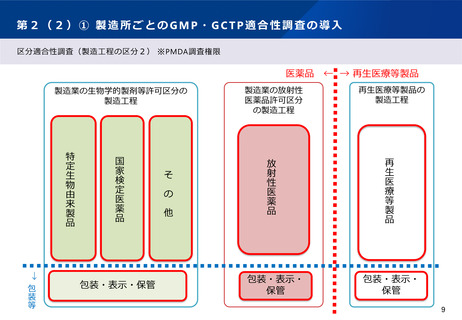
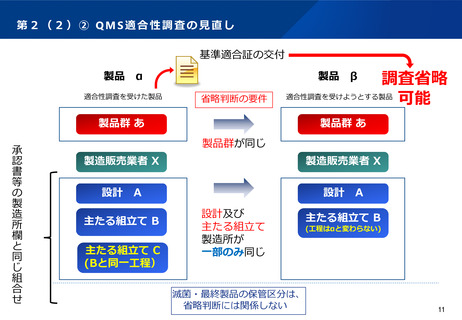
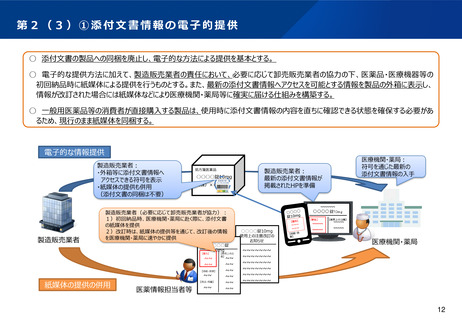
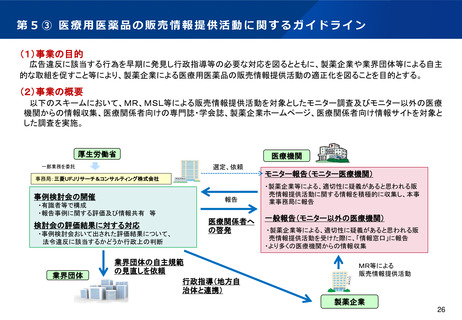
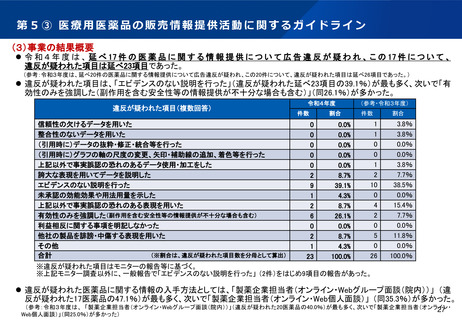
第5② 医薬品等行政評価・監視委員会について(全体概略)
1
経緯等
⚫ 平成22年の「薬害再発防止のための医薬品行政等の見直しについて(最終提言)」(注1)において、医薬品行政の評価・監視
機能を有する機関の設置の必要性が指摘。
(注1)薬害C型肝炎の原告団・弁護団との協議を経て設置された「薬害肝炎事件の検証及び再発防止のための医薬品行政のあり方検討委員会」が作成
⚫ 令和元年12月に、厚生労働省に「医薬品等行政評価・監視委員会」(以下「評価・監視委員会」という。)を設置する規定
を含む改正医薬品医療機器法が公布。
⚫ 令和2年9月に評価・監視委員会が発足。
2
評価・監視委員会の主な役割
医薬品安全行政の「全般」、「個別医薬品」の安全性に関し、
① 行政機関に対して施策の実施状況の評価・監視、
② 必要に応じて安全性の確保等のために講ずべき施策を厚生労働大臣に意見又は勧告、を行う。
(具体的役割)
(1) 厚生労働省・PMDA(医薬品医療機器総合機構)から定期的に医薬品の安全に関する情報(注2)の報告を受ける。
(注2)製造販売承認、医薬品情報の伝達、副作用報告等の安全に関する情報(薬食審の情報等を活用)
(2)
(3)
(4)
(5)
3
⚫
⚫
⚫
行政機関に対する①情報収集、②資料提出、③意見表明等、必要な協力を求める。
収集した情報に基づき医薬品の安全性を評価。
委員会が必要と認める場合、委員会の自ら調査による追加の情報の収集・評価(外部委託を含む)。
委員会が必要と認める場合、委員会から厚生労働大臣への意見・勧告。
委員等
委員は、以下の属性からなる9名によって構成。
①②薬害被害者(2名)、③市民(医薬品ユーザー)、④医師、⑤薬剤師、
⑥医薬品評価専門家、⑦法律家・倫理専門家、 ⑧薬剤疫学専門家、
⑨医薬品製造技術・品質マネジメントシステム専門家
発足時の委員は、委員の人選の透明性や、独立性を確保する観点から、外部委員からなる選
考委員会において、関連学会等の推薦を踏まえ選任。
第2期委員(R4.9~)は、発足時の選考の考え方を踏襲の上、委員交代を要する領域は、
関連学会等の推薦を踏まえ選任。
4 開催実績・事務局
⚫ 開催実績
令和2年9月以降、計15回開催
※ R6.3現在の実績
※ 約3ヶ月に1度の開催頻度
⚫ 事務局
厚生労働省大臣官房厚生科学課
24
1
経緯等
⚫ 平成22年の「薬害再発防止のための医薬品行政等の見直しについて(最終提言)」(注1)において、医薬品行政の評価・監視
機能を有する機関の設置の必要性が指摘。
(注1)薬害C型肝炎の原告団・弁護団との協議を経て設置された「薬害肝炎事件の検証及び再発防止のための医薬品行政のあり方検討委員会」が作成
⚫ 令和元年12月に、厚生労働省に「医薬品等行政評価・監視委員会」(以下「評価・監視委員会」という。)を設置する規定
を含む改正医薬品医療機器法が公布。
⚫ 令和2年9月に評価・監視委員会が発足。
2
評価・監視委員会の主な役割
医薬品安全行政の「全般」、「個別医薬品」の安全性に関し、
① 行政機関に対して施策の実施状況の評価・監視、
② 必要に応じて安全性の確保等のために講ずべき施策を厚生労働大臣に意見又は勧告、を行う。
(具体的役割)
(1) 厚生労働省・PMDA(医薬品医療機器総合機構)から定期的に医薬品の安全に関する情報(注2)の報告を受ける。
(注2)製造販売承認、医薬品情報の伝達、副作用報告等の安全に関する情報(薬食審の情報等を活用)
(2)
(3)
(4)
(5)
3
⚫
⚫
⚫
行政機関に対する①情報収集、②資料提出、③意見表明等、必要な協力を求める。
収集した情報に基づき医薬品の安全性を評価。
委員会が必要と認める場合、委員会の自ら調査による追加の情報の収集・評価(外部委託を含む)。
委員会が必要と認める場合、委員会から厚生労働大臣への意見・勧告。
委員等
委員は、以下の属性からなる9名によって構成。
①②薬害被害者(2名)、③市民(医薬品ユーザー)、④医師、⑤薬剤師、
⑥医薬品評価専門家、⑦法律家・倫理専門家、 ⑧薬剤疫学専門家、
⑨医薬品製造技術・品質マネジメントシステム専門家
発足時の委員は、委員の人選の透明性や、独立性を確保する観点から、外部委員からなる選
考委員会において、関連学会等の推薦を踏まえ選任。
第2期委員(R4.9~)は、発足時の選考の考え方を踏襲の上、委員交代を要する領域は、
関連学会等の推薦を踏まえ選任。
4 開催実績・事務局
⚫ 開催実績
令和2年9月以降、計15回開催
※ R6.3現在の実績
※ 約3ヶ月に1度の開催頻度
⚫ 事務局
厚生労働省大臣官房厚生科学課
24