よむ、つかう、まなぶ。
【資料1-2】前回の制度改正における見直し事項の対応状況について(参考資料) (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_39786.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和6年度第1回 4/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
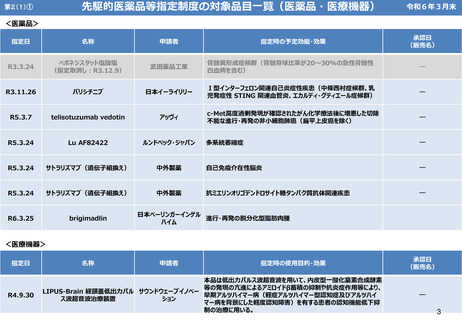
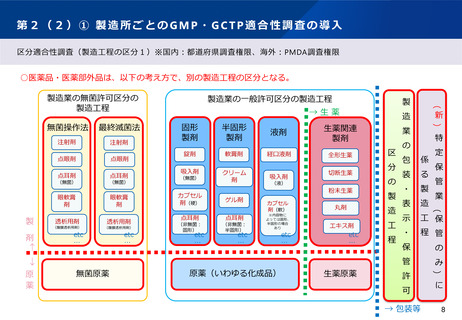
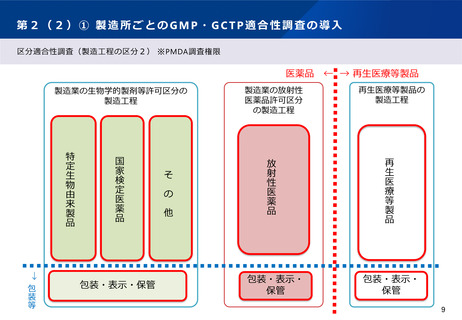
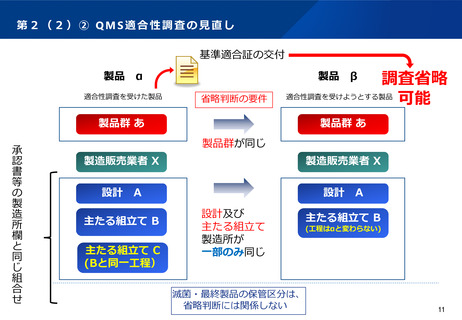
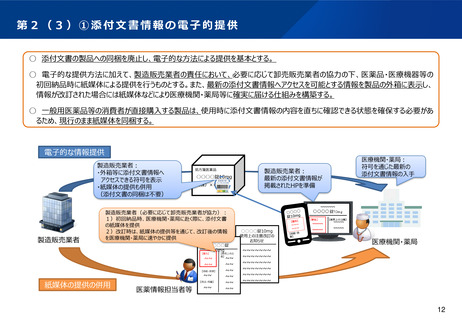
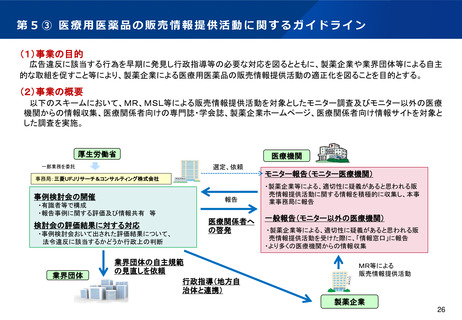
第2(1)① 先駆的医薬品指定制度
「日本再興戦略」改訂2014(平成26年6月24日)に基づき、世界に先駆けて、革新的医薬品・医療機
器・再生医療等製品を日本で早期に実用化すべく、世界に先駆けて開発され、早期の治験段階で著明
な有効性が見込まれる医薬品等を指定し、各種支援による早期の実用化(例えば、医薬品では
通常の半分の6ヶ月間で承認)を目指す「先駆け審査指定制度」を平成27年4月1日より試行的に開
始(通知)。今回の薬機法改正で「先駆的医薬品等」の指定制度として法制化。
指定基準
※医薬品の場合
1.治療薬の画期性:原則として、以下のいずれかに該当するものであること
・既承認薬と異なる新作用機序であること
・既承認薬と同じ作用機序であっても開発対象とする疾患への適応は初めてであること
・革新的な薬物送達システムを用いていること
2.対象疾患の重篤性:生命に重大な影響がある重篤な疾患又は根治療法がなく症状(社会生活が困
難な状態)が継続している疾患
3.対象疾患に係る極めて高い有効性:既承認薬が存在しない、又は既承認薬・治療法に比べて有効
性の大幅な改善が見込まれる、若しくは著しい安全性の向上が見込まれること
4.世界に先駆けて日本で早期開発・申請する意思・体制(同時申請も含む。)
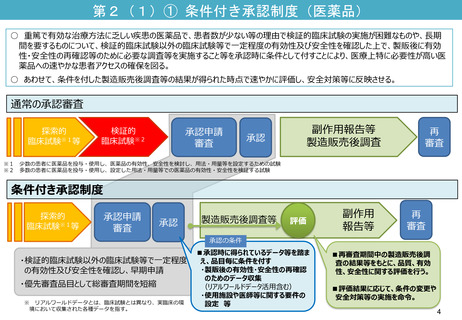
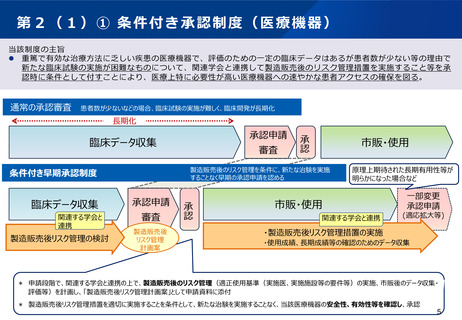
指定制度の内容
①優先相談
〔 2か月 → 1か月 〕
○ 優先対面助言。随時募集対応と
することで事実上1か月で実施。
:承認取得までの期間の短縮に関するもの
②事前評価の充実
〔 実質的な審査の前倒し 〕
○ 事前評価を充実させる。
④審査パートナー制度
〔 PMDA版コンシェルジュ 〕
○ 専任の担当部長級職員をコンシェルジュとして指
定。節目ごとに進捗確認等を行い、必要な部署との
連絡調整を行うことにより、円滑な開発を促進する。
:その他開発促進に関する取組
③優先審査
〔 12か月 → 6か月 〕
○ 総審査期間の目標を、6か月に。
※②事前評価による審査の前倒し
⑤製造販売後の安全対策充実
〔 再審査期間の延長 〕
○ 法律に基づき、再審査期間を延長し、最長10年
までの範囲内で設定する。
1
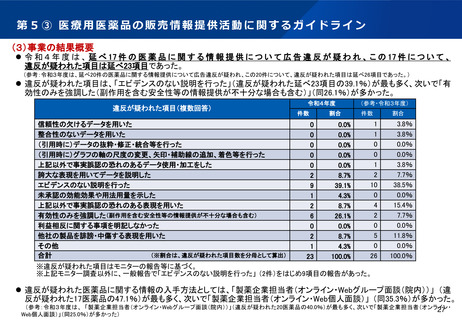
「日本再興戦略」改訂2014(平成26年6月24日)に基づき、世界に先駆けて、革新的医薬品・医療機
器・再生医療等製品を日本で早期に実用化すべく、世界に先駆けて開発され、早期の治験段階で著明
な有効性が見込まれる医薬品等を指定し、各種支援による早期の実用化(例えば、医薬品では
通常の半分の6ヶ月間で承認)を目指す「先駆け審査指定制度」を平成27年4月1日より試行的に開
始(通知)。今回の薬機法改正で「先駆的医薬品等」の指定制度として法制化。
指定基準
※医薬品の場合
1.治療薬の画期性:原則として、以下のいずれかに該当するものであること
・既承認薬と異なる新作用機序であること
・既承認薬と同じ作用機序であっても開発対象とする疾患への適応は初めてであること
・革新的な薬物送達システムを用いていること
2.対象疾患の重篤性:生命に重大な影響がある重篤な疾患又は根治療法がなく症状(社会生活が困
難な状態)が継続している疾患
3.対象疾患に係る極めて高い有効性:既承認薬が存在しない、又は既承認薬・治療法に比べて有効
性の大幅な改善が見込まれる、若しくは著しい安全性の向上が見込まれること
4.世界に先駆けて日本で早期開発・申請する意思・体制(同時申請も含む。)
指定制度の内容
①優先相談
〔 2か月 → 1か月 〕
○ 優先対面助言。随時募集対応と
することで事実上1か月で実施。
:承認取得までの期間の短縮に関するもの
②事前評価の充実
〔 実質的な審査の前倒し 〕
○ 事前評価を充実させる。
④審査パートナー制度
〔 PMDA版コンシェルジュ 〕
○ 専任の担当部長級職員をコンシェルジュとして指
定。節目ごとに進捗確認等を行い、必要な部署との
連絡調整を行うことにより、円滑な開発を促進する。
:その他開発促進に関する取組
③優先審査
〔 12か月 → 6か月 〕
○ 総審査期間の目標を、6か月に。
※②事前評価による審査の前倒し
⑤製造販売後の安全対策充実
〔 再審査期間の延長 〕
○ 法律に基づき、再審査期間を延長し、最長10年
までの範囲内で設定する。
1