よむ、つかう、まなぶ。
資料2-2 [1.3MB] (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_38855.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(令和5年度第15回 3/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
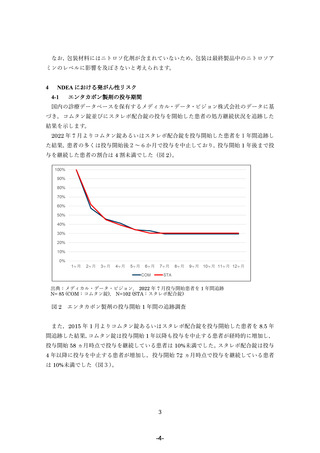
り,定量試験において評価されたコムタン錠のロット毎 NDEA の平均検出量は 0.08096
ppm でした。理論的発がんリスクについては,投与期間を 10 年間として算出しました。
1600 mg/⽇(1 ⽇最⼤投与量)を 10 年間投与した場合の発がんリスク:
(0.08096 ppm×1600 mg÷26.5 ng)/(70 years÷10 years)×10-5= 0.70 ×10-5
(10 万⼈当たり 0.70 ⼈,およそ 143,000 ⼈に 1 ⼈)
以上より,エンタカポンを 10 年間投与した場合の発がんリスクは 0.70×10-5 と推定されま
す。これはおよそ 143,000 ⼈に 1 ⼈が⽣涯(70 年間)その曝露により過剰にがんを発症す
る程度のリスクに相当します。
4-5
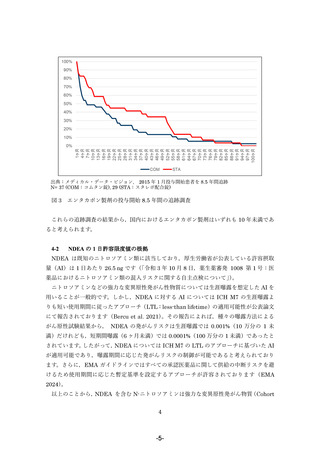
有害事象の状況
コムタン錠及びスタレボ配合錠で報告された悪性腫瘍の副作⽤等症例情報*を同定するた
め,弊社の安全性データベースから MedDRA 標準検索式「悪性疾患」を⽤いて国内症例を
検索しました(2024 年 2 ⽉ 29 ⽇時点)。コムタン錠では,2007 年1⽉の承認以降8例が特
定され,報告された事象は褐⾊細胞腫が 2 例,⾷道癌,乳癌,胆嚢癌,胃癌,結腸癌,急性
リンパ性⽩⾎病が各 1 例でした。また,スタレボ配合錠では,2014 年 7 ⽉の承認以降 6 例
が特定され,報告された事象は褐⾊細胞腫,胃癌,結腸癌,消化管間質性腫瘍,前⽴腺癌,
悪性新⽣物が各 1 例でした。いずれの事象も因果関係は不明です。
*:医薬品医療機器等法第 68 条の 10 に基づく副作⽤等報告
5
今後の対応
以上の評価結果を踏まえ,エンタカポン製剤について,以下の対応を実施⼜は予定してい
ます。
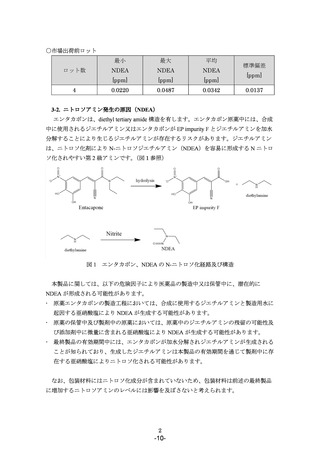
すべての製剤ロットについて出荷前に NDEA の試験を実施し, 0.1105 ppm ( AI×
6.7)を超えない製品を出荷いたします。
出荷済みの製品のうち,0.1105 ppm ( AI×6.7)を超える製品は⾃主回収(クラス II)
を⾏います。
医療機関等に対し,エンタカポン製剤の健康影響評価の結果を情報提供いたします。
また,エンタカポン製剤をはじめ⼀般的にパーキンソン病の治療を変更・中⽌する場
合は,患者の状態を⼗分に観察しながら投与量を漸減し,必要に応じて併⽤している
薬剤の⽤量調整をするなど注意深く⾏う必要があるとされていることから,医療機
関等に対し,⾃⼰の判断のみで本剤の服⽤を中⽌しないよう患者様へ説明してほし
い旨を周知いたします。
NDEA 発⽣の原因調査等を継続し,低減措置につきまして引き続き検討いたします。
6
-7-
ppm でした。理論的発がんリスクについては,投与期間を 10 年間として算出しました。
1600 mg/⽇(1 ⽇最⼤投与量)を 10 年間投与した場合の発がんリスク:
(0.08096 ppm×1600 mg÷26.5 ng)/(70 years÷10 years)×10-5= 0.70 ×10-5
(10 万⼈当たり 0.70 ⼈,およそ 143,000 ⼈に 1 ⼈)
以上より,エンタカポンを 10 年間投与した場合の発がんリスクは 0.70×10-5 と推定されま
す。これはおよそ 143,000 ⼈に 1 ⼈が⽣涯(70 年間)その曝露により過剰にがんを発症す
る程度のリスクに相当します。
4-5
有害事象の状況
コムタン錠及びスタレボ配合錠で報告された悪性腫瘍の副作⽤等症例情報*を同定するた
め,弊社の安全性データベースから MedDRA 標準検索式「悪性疾患」を⽤いて国内症例を
検索しました(2024 年 2 ⽉ 29 ⽇時点)。コムタン錠では,2007 年1⽉の承認以降8例が特
定され,報告された事象は褐⾊細胞腫が 2 例,⾷道癌,乳癌,胆嚢癌,胃癌,結腸癌,急性
リンパ性⽩⾎病が各 1 例でした。また,スタレボ配合錠では,2014 年 7 ⽉の承認以降 6 例
が特定され,報告された事象は褐⾊細胞腫,胃癌,結腸癌,消化管間質性腫瘍,前⽴腺癌,
悪性新⽣物が各 1 例でした。いずれの事象も因果関係は不明です。
*:医薬品医療機器等法第 68 条の 10 に基づく副作⽤等報告
5
今後の対応
以上の評価結果を踏まえ,エンタカポン製剤について,以下の対応を実施⼜は予定してい
ます。
すべての製剤ロットについて出荷前に NDEA の試験を実施し, 0.1105 ppm ( AI×
6.7)を超えない製品を出荷いたします。
出荷済みの製品のうち,0.1105 ppm ( AI×6.7)を超える製品は⾃主回収(クラス II)
を⾏います。
医療機関等に対し,エンタカポン製剤の健康影響評価の結果を情報提供いたします。
また,エンタカポン製剤をはじめ⼀般的にパーキンソン病の治療を変更・中⽌する場
合は,患者の状態を⼗分に観察しながら投与量を漸減し,必要に応じて併⽤している
薬剤の⽤量調整をするなど注意深く⾏う必要があるとされていることから,医療機
関等に対し,⾃⼰の判断のみで本剤の服⽤を中⽌しないよう患者様へ説明してほし
い旨を周知いたします。
NDEA 発⽣の原因調査等を継続し,低減措置につきまして引き続き検討いたします。
6
-7-