よむ、つかう、まなぶ。
【資料3】医薬品等行政評価・監視委員会における海外調査(令和4年度・欧米の薬事制度に関する調査) (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
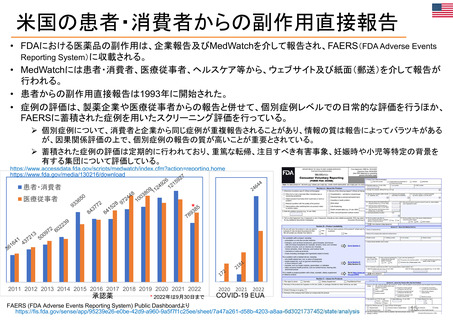
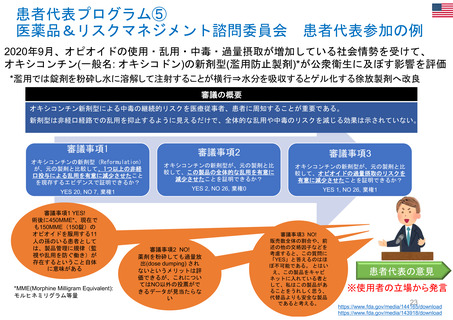
OIGレポートの例②
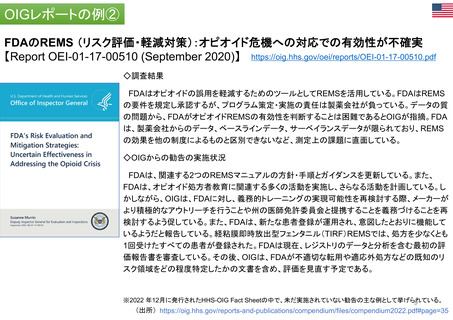
FDAのREMS (リスク評価・軽減対策):オピオイド危機への対応での有効性が不確実
【Report OEI-01-17-00510 (September 2020)】 https://oig.hhs.gov/oei/reports/OEI-01-17-00510.pdf
◇調査結果
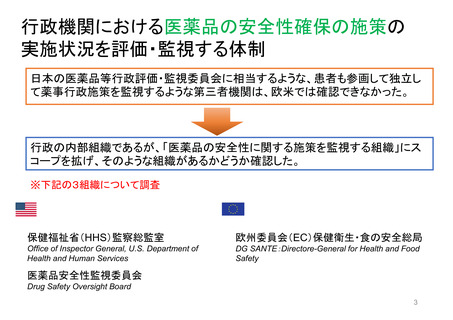
FDAはオピオイドの誤用を軽減するためのツールとしてREMSを活用している。FDAはREMS
の要件を規定し承認するが、プログラム策定・実施の責任は製薬会社が負っている。データの質
の問題から、FDAがオピオイドREMSの有効性を判断することは困難であるとOIGが指摘。FDA
は、製薬会社からのデータ、ベースラインデータ、サーベイランスデータが限られており、REMS
の効果を他の制度によるものと区別できないなど、測定上の課題に直面している。
◇OIGからの勧告の実施状況
FDAは、関連する2つのREMSマニュアルの方針・手順とガイダンスを更新している。また、
FDAは、オピオイド処方者教育に関連する多くの活動を実施し、さらなる活動を計画している。し
かしながら、OIGは、FDAに対し、義務的トレーニングの実現可能性を再検討する際、メーカーが
より積極的なアウトリーチを行うことや州の医師免許委員会と提携することを義務づけることを再
検討するよう促している。また、FDAは、新たな患者登録が運用され、意図したとおりに機能して
いるようだと報告している。経粘膜即時放出型フェンタニル(TIRF)REMSでは、処方を少なくとも
1回受けたすべての患者が登録された。FDAは現在、レジストリのデータと分析を含む最初の評
価報告書を審査している。その後、OIGは、FDAが不適切な転用や適応外処方などの既知のリ
スク領域をどの程度特定したかの文書を含め、評価を見直す予定である。
※2022 年12月に発行されたHHS-OIG Fact Sheetの中で、未だ実施されていない勧告の主な例として挙げられている。
9
(出所) https://oig.hhs.gov/reports-and-publications/compendium/files/compendium2022.pdf#page=35
FDAのREMS (リスク評価・軽減対策):オピオイド危機への対応での有効性が不確実
【Report OEI-01-17-00510 (September 2020)】 https://oig.hhs.gov/oei/reports/OEI-01-17-00510.pdf
◇調査結果
FDAはオピオイドの誤用を軽減するためのツールとしてREMSを活用している。FDAはREMS
の要件を規定し承認するが、プログラム策定・実施の責任は製薬会社が負っている。データの質
の問題から、FDAがオピオイドREMSの有効性を判断することは困難であるとOIGが指摘。FDA
は、製薬会社からのデータ、ベースラインデータ、サーベイランスデータが限られており、REMS
の効果を他の制度によるものと区別できないなど、測定上の課題に直面している。
◇OIGからの勧告の実施状況
FDAは、関連する2つのREMSマニュアルの方針・手順とガイダンスを更新している。また、
FDAは、オピオイド処方者教育に関連する多くの活動を実施し、さらなる活動を計画している。し
かしながら、OIGは、FDAに対し、義務的トレーニングの実現可能性を再検討する際、メーカーが
より積極的なアウトリーチを行うことや州の医師免許委員会と提携することを義務づけることを再
検討するよう促している。また、FDAは、新たな患者登録が運用され、意図したとおりに機能して
いるようだと報告している。経粘膜即時放出型フェンタニル(TIRF)REMSでは、処方を少なくとも
1回受けたすべての患者が登録された。FDAは現在、レジストリのデータと分析を含む最初の評
価報告書を審査している。その後、OIGは、FDAが不適切な転用や適応外処方などの既知のリ
スク領域をどの程度特定したかの文書を含め、評価を見直す予定である。
※2022 年12月に発行されたHHS-OIG Fact Sheetの中で、未だ実施されていない勧告の主な例として挙げられている。
9
(出所) https://oig.hhs.gov/reports-and-publications/compendium/files/compendium2022.pdf#page=35