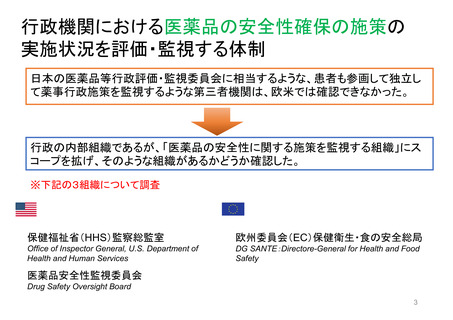
よむ、つかう、まなぶ。
【資料3】医薬品等行政評価・監視委員会における海外調査(令和4年度・欧米の薬事制度に関する調査) (7 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
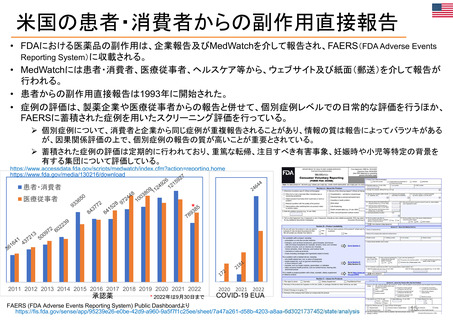
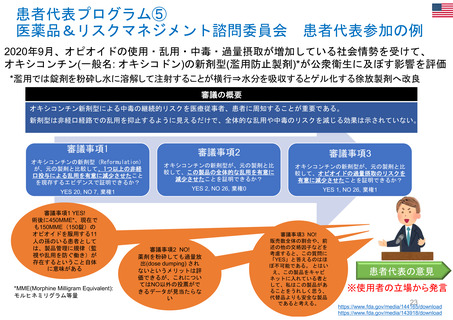
OIGレポートの例①-1
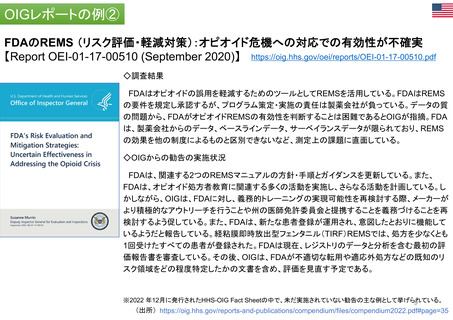
FDAには、REMS (リスク評価・軽減対策)が医薬品安全性を向上させて
いるか判断するための包括的なデータが不足している
【Report OEI-04-11-00510 (February 2013)】
◇OIGのレビュー結果
• FDAは2008~2011年に199件のREMSを承認しており、うち99件
は2012年にもREMSが要求されていた。
• OIGが検討した、スポンサーによるREMS評価49件のほぼ半数は、
FDAの評価計画(FDA assessment plan)で要請された情報のす
べてを含んでおらず、 10件は期限内にFDAに提出されていなかっ
た。
• FDAは、 49件中7件のREMSの目標はすべて達成されていると判
断した。しかしFDAは、REMSの効果を評価するための確実な方
法を見出していない。
• FDAによる評価のレビュー期間は、 1件を除いてすべて目標の60
日間を超えていた。このことにより、スポンサーが次の評価を提出
する前に、 FDAから提案された変更を行うための時間的余裕がな
くなってしまう。
7
(出所) https://oig.hhs.gov/oei/reports/oei-04-11-00510.pdf
FDAには、REMS (リスク評価・軽減対策)が医薬品安全性を向上させて
いるか判断するための包括的なデータが不足している
【Report OEI-04-11-00510 (February 2013)】
◇OIGのレビュー結果
• FDAは2008~2011年に199件のREMSを承認しており、うち99件
は2012年にもREMSが要求されていた。
• OIGが検討した、スポンサーによるREMS評価49件のほぼ半数は、
FDAの評価計画(FDA assessment plan)で要請された情報のす
べてを含んでおらず、 10件は期限内にFDAに提出されていなかっ
た。
• FDAは、 49件中7件のREMSの目標はすべて達成されていると判
断した。しかしFDAは、REMSの効果を評価するための確実な方
法を見出していない。
• FDAによる評価のレビュー期間は、 1件を除いてすべて目標の60
日間を超えていた。このことにより、スポンサーが次の評価を提出
する前に、 FDAから提案された変更を行うための時間的余裕がな
くなってしまう。
7
(出所) https://oig.hhs.gov/oei/reports/oei-04-11-00510.pdf