よむ、つかう、まなぶ。
【資料3】医薬品等行政評価・監視委員会における海外調査(令和4年度・欧米の薬事制度に関する調査) (37 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_32109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第11回 3/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
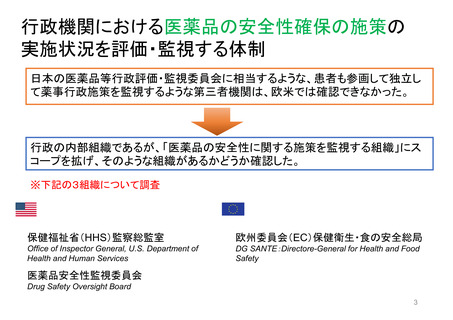
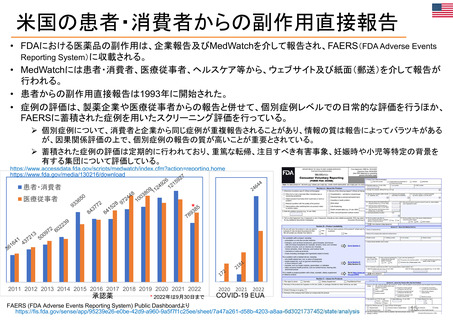
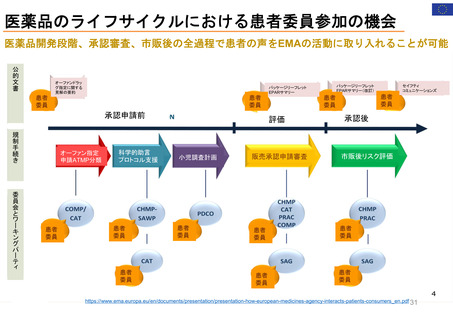
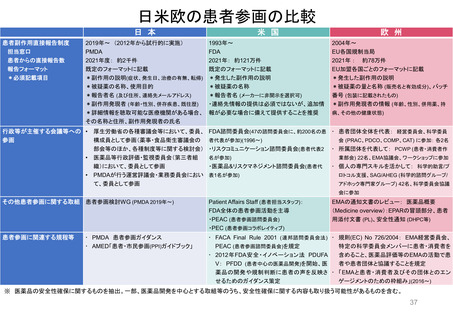
日米欧の患者参画の比較
日 本
患者副作用直接報告制度
担当窓口
患者からの直接報告数
報告フォーマット
*必須記載項目
米 国
欧 州
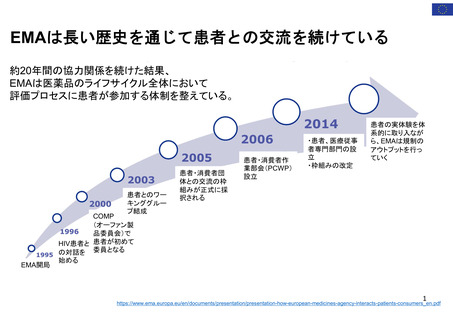
2019年~ (2012年から試行的に実施)
1993年~
2004年~
PMDA
2021年度: 約2千件
既定のフォーマットに記載
*副作用の説明(症状、発生日、治療の有無、転帰)
*被疑薬の名称、使用目的
FDA
2021年: 約121万件
既定のフォーマットに記載
*発生した副作用の説明
*被疑薬の名称
EU各国規制当局
2021年: 約78万件
EU加盟各国ごとのフォーマットに記載
*発生した副作用の説明
*被疑薬の量と名称 (販売名と有効成分)、バッチ
*報告者名 (及び住所、連絡先メールアドレス)
*報告者名 (メーカーに非開示を選択可)
*副作用発現者 (年齢・性別、併存疾患、既往歴)
・連絡先情報の提供は必須ではないが、追加情
*詳細情報を聴取可能な医療機関がある場合、 報が必要な場合に備えて提供することを推奨
その名称と住所、副作用発現者の氏名
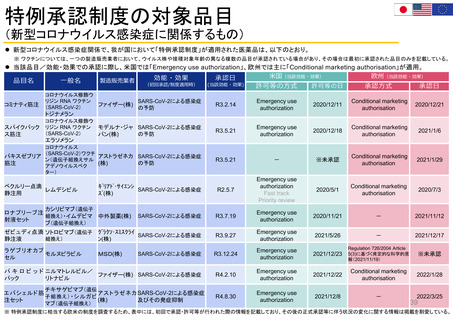
行政等が主催する会議等への • 厚生労働省の各種審議会等において、委員、
参画
構成員として参画(薬事・食品衛生審議会の
部会等のほか、各種制度等に関する検討会)
• 医薬品等行政評価・監視委員会(第三者組
織)において、委員として参画
• PMDAが行う運営評議会・業務委員会におい
て、委員として参画
番号 (包装に記載されたもの)
*副作用発現者の情報 (年齢、性別、併用薬、持
病、その他の健康状態)
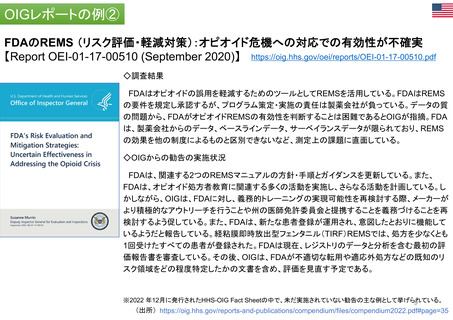
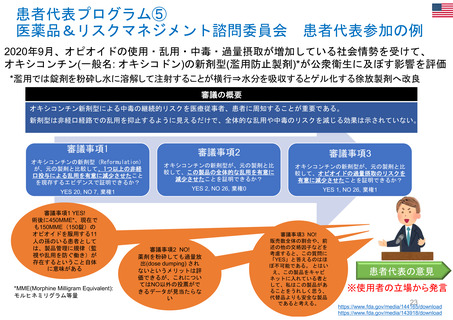
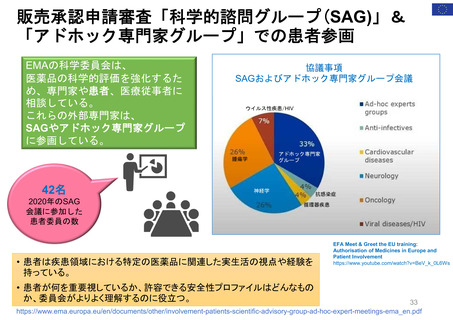
FDA諮問委員会(47の諮問委員会に、約200名の患
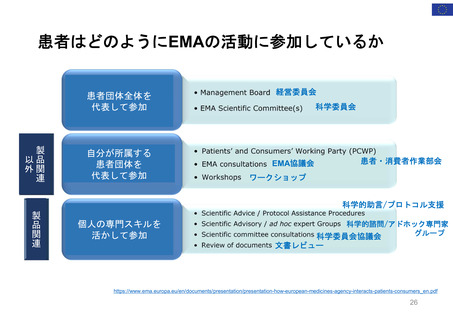
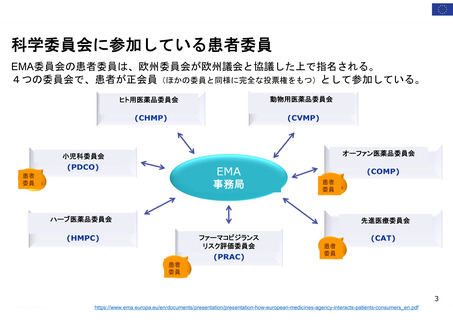
患者団体全体を代表: 経営委員会、科学委員
者代表が参加)(1996~)
会 (PRAC、PDCO、COMP、CAT) に参加: 各2名
・リスクコミュニケーション諮問委員会(患者代表2
所属団体を代表して: PCWP (患者・消費者作
名が参加)
業部会) 22名、EMA協議会、ワークショップに参加
・医薬品&リスクマネジメント諮問委員会(患者代
個人の専門スキルを活かして: 科学的助言/プ
表1名が参加)
ロトコル支援、SAG/AHEG (科学的諮問グループ/
アドホック専門家グループ) 42名、科学委員会協議
会に参加
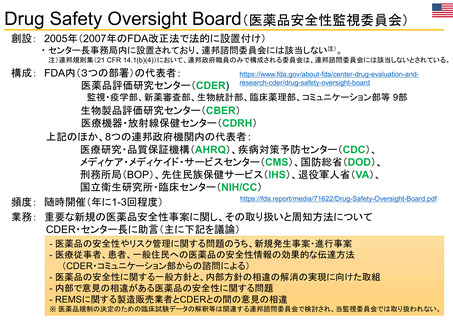
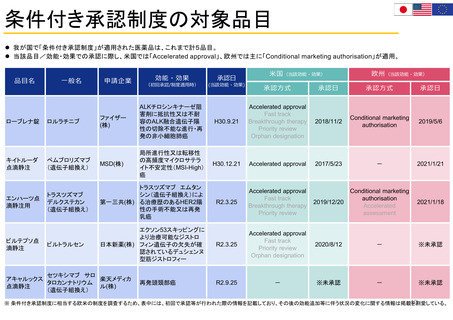
その他患者参画に関する取組 患者参画検討WG (PMDA 2019年~)
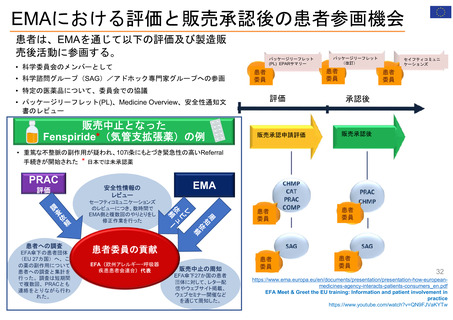
Patient Affairs Staff (患者担当スタッフ):
EMAの通知文書のレビュー: 医薬品概要
FDA全体の患者参画活動を主導
・PEAC (患者参画諮問委員会)
(Medicine overview):EPARの冒頭部分、患者
用添付文書 (PL)、安全性通知 (DHPC等)
・PEC (患者参画コラボレイティブ)
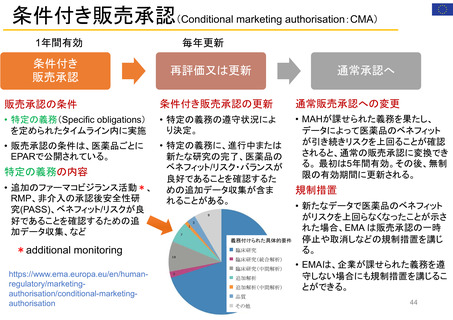
患者参画に関連する規程等
PMDA 患者参画ガイダンス
FACA Final Rule 2001 (連邦諮問委員会法)
規則(EC) No 726/2004: EMA経営委員会、
AMED「患者・市民参画(PPI)ガイドブック」
PEAC (患者参画諮問委員会)を規定
2012年FDA安全・イノベーション法 PDUFA
特定の科学委員会メンバーに患者・消費者を
含めること、医薬品評価等のEMAの活動で患
V: PFDD (患者中心の医薬品開発)を開始、医
者や患者団体と協議することを規定
薬品の開発や規制判断に患者の声を反映さ
せるためのガイダンス策定
「EMAと患者・消費者及びその団体とのエン
ゲージメントのための枠組み」(2016~)
※ 医薬品の安全性確保に関するものを抽出。一部、医薬品開発を中心とする取組等のうち、安全性確保に関する内容も取り扱う可能性があるものを含む。
37
日 本
患者副作用直接報告制度
担当窓口
患者からの直接報告数
報告フォーマット
*必須記載項目
米 国
欧 州
2019年~ (2012年から試行的に実施)
1993年~
2004年~
PMDA
2021年度: 約2千件
既定のフォーマットに記載
*副作用の説明(症状、発生日、治療の有無、転帰)
*被疑薬の名称、使用目的
FDA
2021年: 約121万件
既定のフォーマットに記載
*発生した副作用の説明
*被疑薬の名称
EU各国規制当局
2021年: 約78万件
EU加盟各国ごとのフォーマットに記載
*発生した副作用の説明
*被疑薬の量と名称 (販売名と有効成分)、バッチ
*報告者名 (及び住所、連絡先メールアドレス)
*報告者名 (メーカーに非開示を選択可)
*副作用発現者 (年齢・性別、併存疾患、既往歴)
・連絡先情報の提供は必須ではないが、追加情
*詳細情報を聴取可能な医療機関がある場合、 報が必要な場合に備えて提供することを推奨
その名称と住所、副作用発現者の氏名
行政等が主催する会議等への • 厚生労働省の各種審議会等において、委員、
参画
構成員として参画(薬事・食品衛生審議会の
部会等のほか、各種制度等に関する検討会)
• 医薬品等行政評価・監視委員会(第三者組
織)において、委員として参画
• PMDAが行う運営評議会・業務委員会におい
て、委員として参画
番号 (包装に記載されたもの)
*副作用発現者の情報 (年齢、性別、併用薬、持
病、その他の健康状態)
FDA諮問委員会(47の諮問委員会に、約200名の患
患者団体全体を代表: 経営委員会、科学委員
者代表が参加)(1996~)
会 (PRAC、PDCO、COMP、CAT) に参加: 各2名
・リスクコミュニケーション諮問委員会(患者代表2
所属団体を代表して: PCWP (患者・消費者作
名が参加)
業部会) 22名、EMA協議会、ワークショップに参加
・医薬品&リスクマネジメント諮問委員会(患者代
個人の専門スキルを活かして: 科学的助言/プ
表1名が参加)
ロトコル支援、SAG/AHEG (科学的諮問グループ/
アドホック専門家グループ) 42名、科学委員会協議
会に参加
その他患者参画に関する取組 患者参画検討WG (PMDA 2019年~)
Patient Affairs Staff (患者担当スタッフ):
EMAの通知文書のレビュー: 医薬品概要
FDA全体の患者参画活動を主導
・PEAC (患者参画諮問委員会)
(Medicine overview):EPARの冒頭部分、患者
用添付文書 (PL)、安全性通知 (DHPC等)
・PEC (患者参画コラボレイティブ)
患者参画に関連する規程等
PMDA 患者参画ガイダンス
FACA Final Rule 2001 (連邦諮問委員会法)
規則(EC) No 726/2004: EMA経営委員会、
AMED「患者・市民参画(PPI)ガイドブック」
PEAC (患者参画諮問委員会)を規定
2012年FDA安全・イノベーション法 PDUFA
特定の科学委員会メンバーに患者・消費者を
含めること、医薬品評価等のEMAの活動で患
V: PFDD (患者中心の医薬品開発)を開始、医
者や患者団体と協議することを規定
薬品の開発や規制判断に患者の声を反映さ
せるためのガイダンス策定
「EMAと患者・消費者及びその団体とのエン
ゲージメントのための枠組み」(2016~)
※ 医薬品の安全性確保に関するものを抽出。一部、医薬品開発を中心とする取組等のうち、安全性確保に関する内容も取り扱う可能性があるものを含む。
37