よむ、つかう、まなぶ。
03【資料1】海外製インフルワクチンの製造供給プロセス案について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_30319.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会 研究開発及び生産・流通部会(第31回 1/25)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
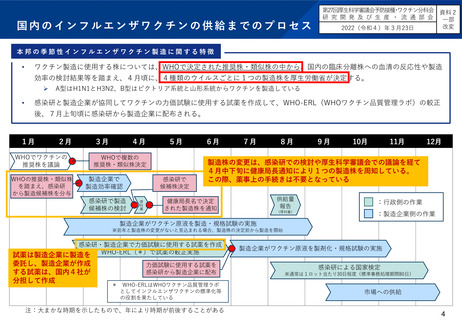
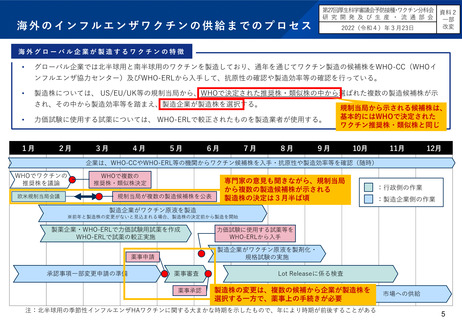
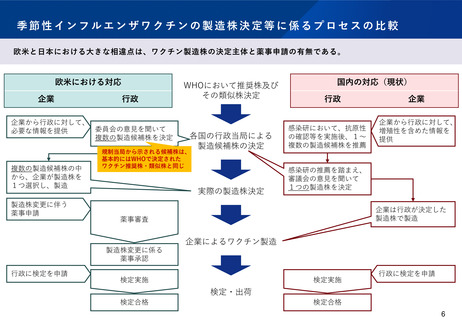
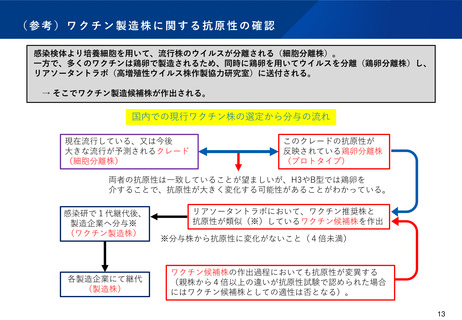
季節性インフルエンザワクチンの製造株決定等に係るプロセスの比較
欧米と日本における大きな相違点は、ワクチン製造株の決定主体と薬事申請の有無である。
欧米における対応
企業
行政
企業から行政に対して、
委員会の意見を聞いて
必要な情報を提供
複数の製造候補株を決定
複数の製造候補株の中
から、企業が製造株を
1つ選択し、製造
製造株変更に伴う
薬事申請
WHOにおいて推奨株及び
その類似株決定
各国の行政当局による
製造候補株の決定
規制当局から示される候補株は、
基本的にはWHOで決定された
ワクチン推奨株・類似株と同じ
実際の製造株決定
国内の対応(現状)
行政
感染研において、抗原性
の確認等を実施後、1~
複数の製造候補株を推薦
企業
企業から行政に対して、
増殖性を含めた情報を
提供
感染研の推薦を踏まえ、
審議会の意見を聞いて
1つの製造株を決定
企業は行政が決定した
製造株で製造
薬事審査
企業によるワクチン製造
製造株変更に係る
薬事承認
行政に検定を申請
検定実施
検定実施
行政に検定を申請
検定・出荷
検定合格
検定合格
6
欧米と日本における大きな相違点は、ワクチン製造株の決定主体と薬事申請の有無である。
欧米における対応
企業
行政
企業から行政に対して、
委員会の意見を聞いて
必要な情報を提供
複数の製造候補株を決定
複数の製造候補株の中
から、企業が製造株を
1つ選択し、製造
製造株変更に伴う
薬事申請
WHOにおいて推奨株及び
その類似株決定
各国の行政当局による
製造候補株の決定
規制当局から示される候補株は、
基本的にはWHOで決定された
ワクチン推奨株・類似株と同じ
実際の製造株決定
国内の対応(現状)
行政
感染研において、抗原性
の確認等を実施後、1~
複数の製造候補株を推薦
企業
企業から行政に対して、
増殖性を含めた情報を
提供
感染研の推薦を踏まえ、
審議会の意見を聞いて
1つの製造株を決定
企業は行政が決定した
製造株で製造
薬事審査
企業によるワクチン製造
製造株変更に係る
薬事承認
行政に検定を申請
検定実施
検定実施
行政に検定を申請
検定・出荷
検定合格
検定合格
6