よむ、つかう、まなぶ。
資料5-3 企業から提出された開発工程表の概要等(第I回要望) (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000198856_00022.html |
| 出典情報 | 医薬・生活衛生局が実施する検討会 医療上の必要性の高い未承認薬・適応外薬検討会議(第50回 1/26)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
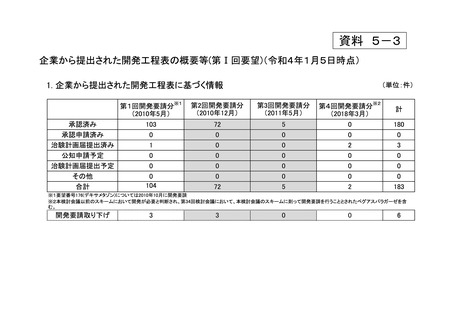
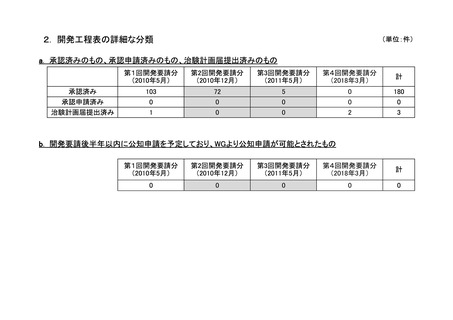
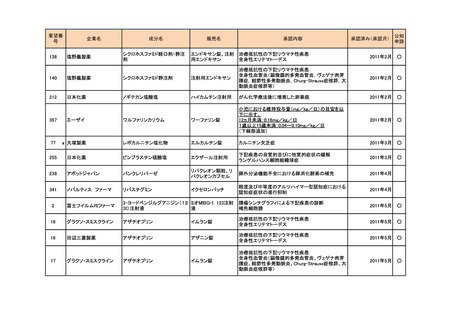
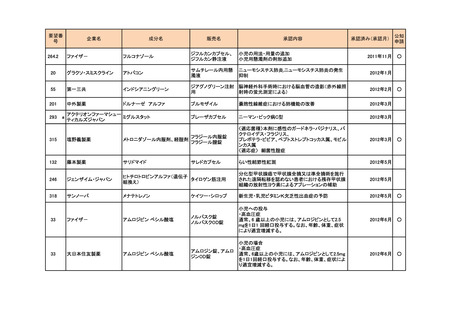
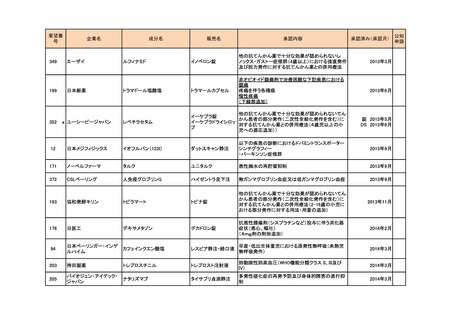
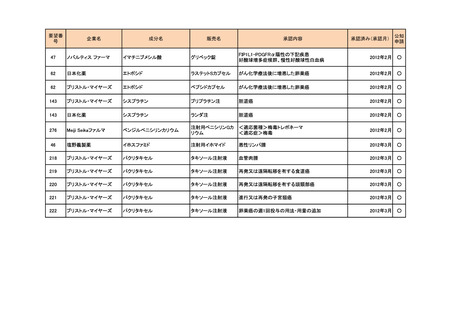
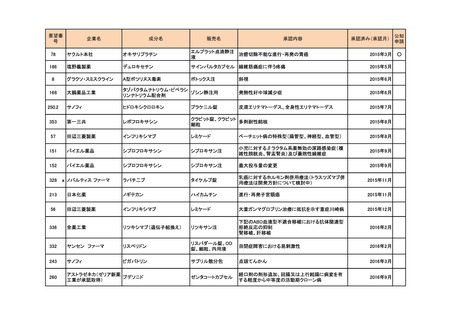
a-2. 治験計画届提出済みのもの(3件)
<第1回開発要請分(1件)>
要望番号
173
企業名
サノフィ
成分名
チフス菌Vi多糖体抗原ワクチン
販売名
Typhim Vi
要請内容
腸チフスの感染予防
特記事項
承認申請準備中
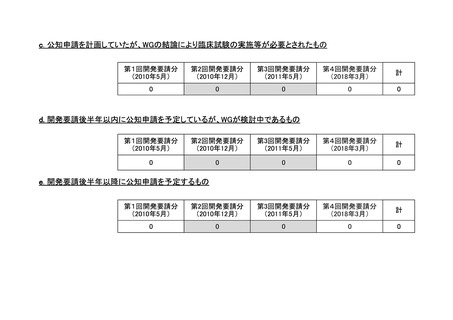
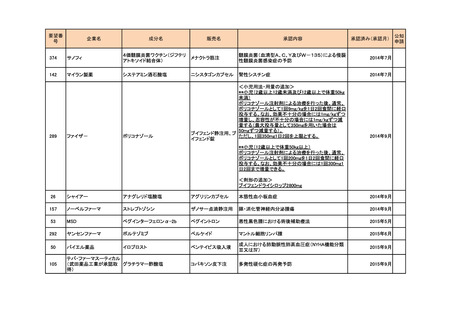
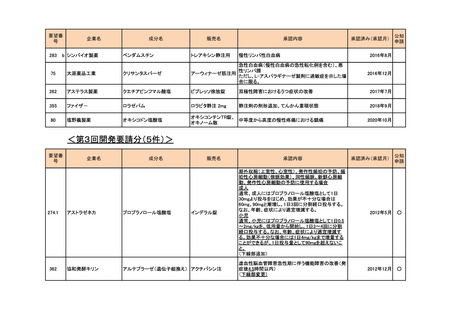
<第2回開発要請分(0件)>
<第3回開発要請分(0件)>
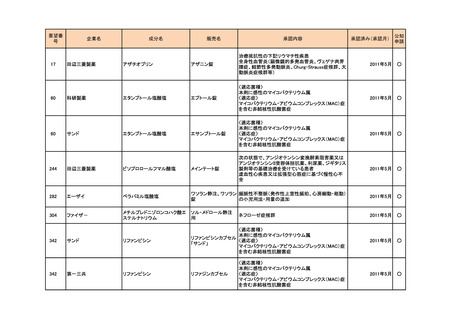
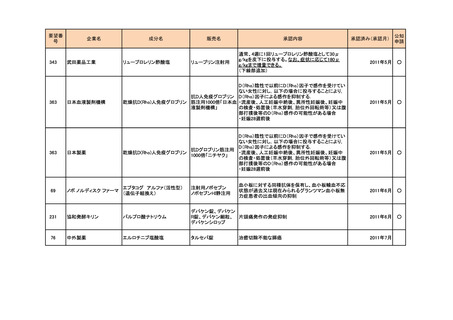
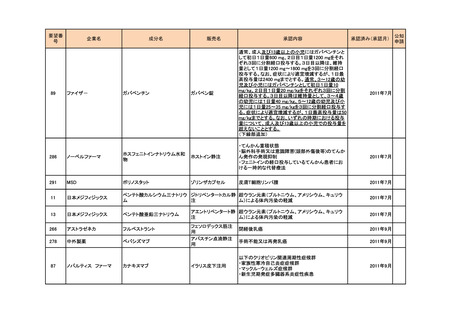
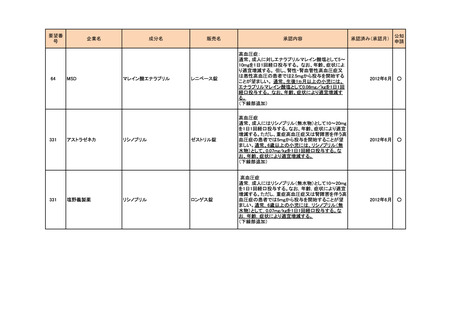
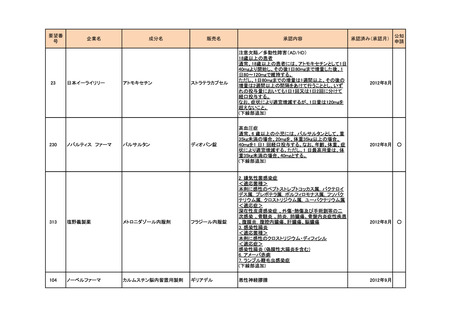
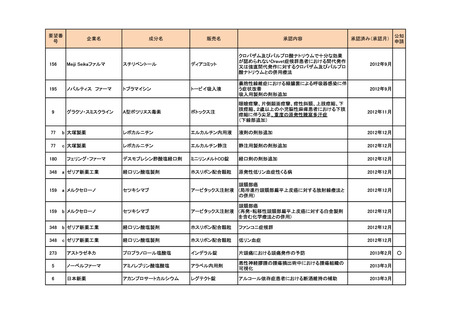
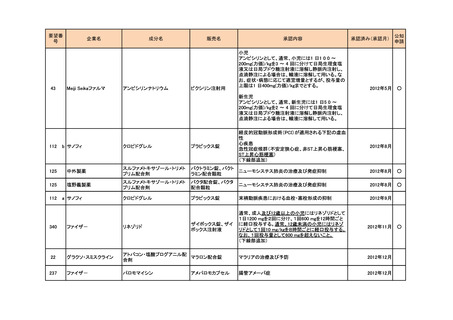
<第4回開発要請分(2件)>
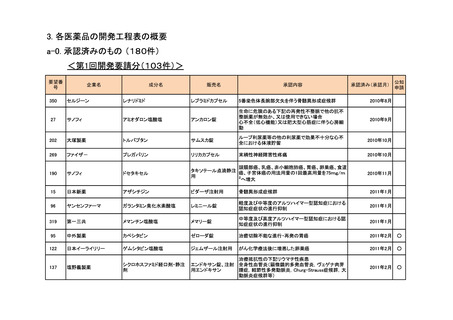
要望番号
企業名
成分名
販売名
開発内容
1
ダイドーファーマ
Amifampridine (INN)
販売名未定
Lambert-Eaton筋無力症候群による筋力低下の改
善
※
協和キリン
日本セルヴィエ
ペグアスパラガーゼ
販売名未定
急性リンパ性白血病
特記事項
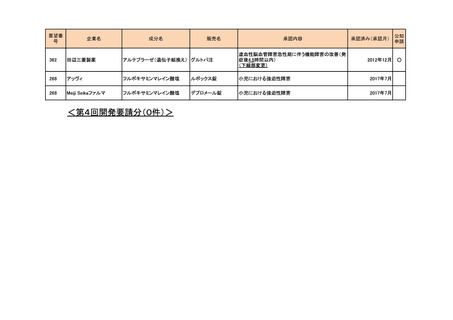
※本品目は、未承認薬検討会議以前のスキームにおいて医療上の必要性が高いとされた品目であるが、第34回検討会議の議論を踏まえ開発要請をおこなったもの。
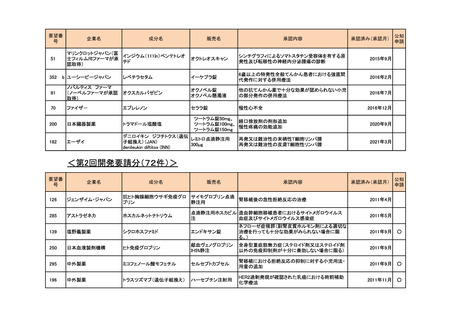
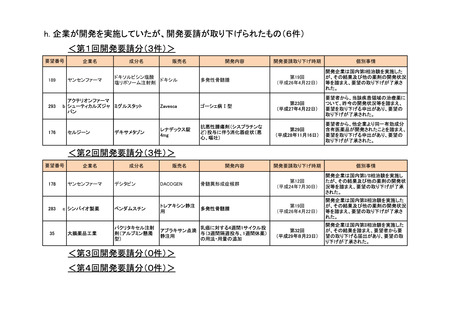
<第1回開発要請分(1件)>
要望番号
173
企業名
サノフィ
成分名
チフス菌Vi多糖体抗原ワクチン
販売名
Typhim Vi
要請内容
腸チフスの感染予防
特記事項
承認申請準備中
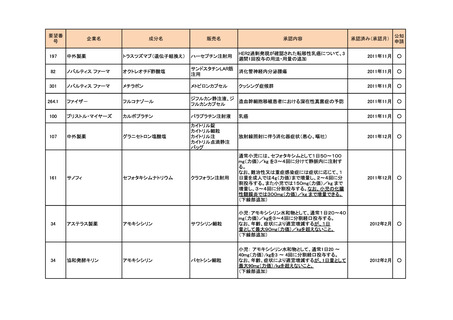
<第2回開発要請分(0件)>
<第3回開発要請分(0件)>
<第4回開発要請分(2件)>
要望番号
企業名
成分名
販売名
開発内容
1
ダイドーファーマ
Amifampridine (INN)
販売名未定
Lambert-Eaton筋無力症候群による筋力低下の改
善
※
協和キリン
日本セルヴィエ
ペグアスパラガーゼ
販売名未定
急性リンパ性白血病
特記事項
※本品目は、未承認薬検討会議以前のスキームにおいて医療上の必要性が高いとされた品目であるが、第34回検討会議の議論を踏まえ開発要請をおこなったもの。