よむ、つかう、まなぶ。
in vivo遺伝子治療に対する規制の検討(法の対象とする関連技術の範囲について) (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27055.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第79回 7/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
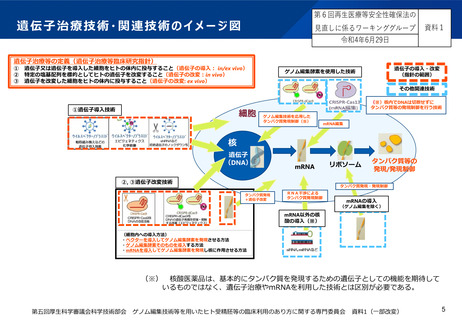
mRNAを利用した技術について
第6回再生医療等安全性確保法の
見直しに係るワーキンググループ
資料1
令和4年6月29日
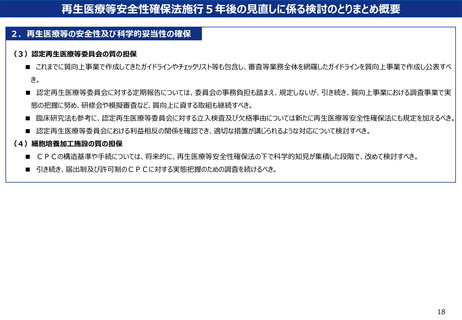
現状
•
mRNAを利用した医薬品等については、現在感染症予防に用いる製品が市販されているが、
mRNAを疾病治療に利用した技術についても、国内外で研究開発が進められている。
•
再生医療等安全性確保法に現在も含まれているex vivo遺伝子治療の一例として、体外でキメ
ラ抗原受容体 (chimeric antigen receptor: CAR) をT細胞に発現させるCAR-T細胞療法が
あるが、昨今、mRNAを利用した技術を用いることで、体内で直接T細胞にCARを発現させ
る技術が開発されている。
mRNAの分類
•
海外規制当局(米国食品医薬品局)では、プラスミドベクター製品と同様に、「インビトロ
転写によって製造されるRNA」も遺伝子治療に含めるとしている。
•
本邦の規制当局でも、薬機法において、予防ではなく治療を目的とするmRNAを利用した技
術は、遺伝子治療用製品に含むと考えている。
•
そういった観点からは、 再生医療等安全性確保法においても、薬機法の対象とならない自由
診療や臨床研究におけるmRNAを利用した技術は、遺伝子治療関連技術に含まれると考える
のが妥当ではないか。
6
第6回再生医療等安全性確保法の
見直しに係るワーキンググループ
資料1
令和4年6月29日
現状
•
mRNAを利用した医薬品等については、現在感染症予防に用いる製品が市販されているが、
mRNAを疾病治療に利用した技術についても、国内外で研究開発が進められている。
•
再生医療等安全性確保法に現在も含まれているex vivo遺伝子治療の一例として、体外でキメ
ラ抗原受容体 (chimeric antigen receptor: CAR) をT細胞に発現させるCAR-T細胞療法が
あるが、昨今、mRNAを利用した技術を用いることで、体内で直接T細胞にCARを発現させ
る技術が開発されている。
mRNAの分類
•
海外規制当局(米国食品医薬品局)では、プラスミドベクター製品と同様に、「インビトロ
転写によって製造されるRNA」も遺伝子治療に含めるとしている。
•
本邦の規制当局でも、薬機法において、予防ではなく治療を目的とするmRNAを利用した技
術は、遺伝子治療用製品に含むと考えている。
•
そういった観点からは、 再生医療等安全性確保法においても、薬機法の対象とならない自由
診療や臨床研究におけるmRNAを利用した技術は、遺伝子治療関連技術に含まれると考える
のが妥当ではないか。
6