よむ、つかう、まなぶ。
in vivo遺伝子治療に対する規制の検討(法の対象とする関連技術の範囲について) (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27055.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第79回 7/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
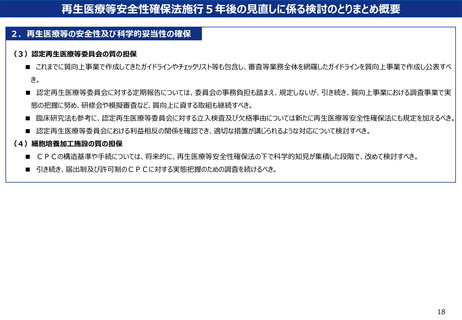
再生医療等安全性確保法施行5年後の見直しに係る検討のとりまとめ概要
1.医療技術等の変化への対応
(2)再生医療等のリスク分類・法の適用除外範囲の見直し
(ⅰ) ゲノム編集技術について
■ ゲノム編集技術を応用した技術をはじめとする関連技術も含め、認定再生医療等委員会における審査の際の考え方等の具体的なリスクの評価方法
について検討すべき。
(ⅱ) その他の再生医療等技術について
<リスク分類・適用除外範囲の見直し全般について>
■ 再生医療等技術のリスク分類については、将来的に科学的知見が集積した段階で、改めてリスク分類の考え方を検討すべき。
<特に検討を行うべき再生医療等技術について>
■ 医薬品医療機器等法に基づき適応症を含む承認を取得した医療機器をその適応範囲内で利用する場合においては、再生医療等安全性確保法の
適用範囲から除外すべき。
■ 保険収載された第1種再生医療等技術に関しては、事前に本部会委員と事務局により書類を確認し、指摘事項が修正されたことを確認した後、速
やかに本部会長及び部会長代理に報告し短縮通知の発出を行い、直近の部会開催において当該処理をした計画について報告すべき。
■ 他家間葉系幹細胞を利用した医療技術については、引き続き、第1種再生医療等技術として位置づけることとする。将来的に、再生医療等安全性
確保法の下で科学的知見が集積した段階で、第1種再生医療等技術として求められる手続の見直しを検討すべき。また、既に承認されている同種由
来再生医療等製品の適応外使用等の部会審査については、保険収載された第1種再生医療等技術と同様の手続緩和の枠組で対応可能か、個
別の技術について事務局と本部会委員とでその都度判断し、手続緩和を検討すべき。
■ エクソソーム等は、細胞断片として整理されるものであり、ヒトへの投与物としての明確な定義づけが困難であることや、諸外国における規制状況等も勘
案し、現時点においては、エクソソーム等を再生医療等安全性確保法の対象とはせず、今後の医療技術の進展を踏まえ、必要に応じ検討すべき。
16
1.医療技術等の変化への対応
(2)再生医療等のリスク分類・法の適用除外範囲の見直し
(ⅰ) ゲノム編集技術について
■ ゲノム編集技術を応用した技術をはじめとする関連技術も含め、認定再生医療等委員会における審査の際の考え方等の具体的なリスクの評価方法
について検討すべき。
(ⅱ) その他の再生医療等技術について
<リスク分類・適用除外範囲の見直し全般について>
■ 再生医療等技術のリスク分類については、将来的に科学的知見が集積した段階で、改めてリスク分類の考え方を検討すべき。
<特に検討を行うべき再生医療等技術について>
■ 医薬品医療機器等法に基づき適応症を含む承認を取得した医療機器をその適応範囲内で利用する場合においては、再生医療等安全性確保法の
適用範囲から除外すべき。
■ 保険収載された第1種再生医療等技術に関しては、事前に本部会委員と事務局により書類を確認し、指摘事項が修正されたことを確認した後、速
やかに本部会長及び部会長代理に報告し短縮通知の発出を行い、直近の部会開催において当該処理をした計画について報告すべき。
■ 他家間葉系幹細胞を利用した医療技術については、引き続き、第1種再生医療等技術として位置づけることとする。将来的に、再生医療等安全性
確保法の下で科学的知見が集積した段階で、第1種再生医療等技術として求められる手続の見直しを検討すべき。また、既に承認されている同種由
来再生医療等製品の適応外使用等の部会審査については、保険収載された第1種再生医療等技術と同様の手続緩和の枠組で対応可能か、個
別の技術について事務局と本部会委員とでその都度判断し、手続緩和を検討すべき。
■ エクソソーム等は、細胞断片として整理されるものであり、ヒトへの投与物としての明確な定義づけが困難であることや、諸外国における規制状況等も勘
案し、現時点においては、エクソソーム等を再生医療等安全性確保法の対象とはせず、今後の医療技術の進展を踏まえ、必要に応じ検討すべき。
16