よむ、つかう、まなぶ。
in vivo遺伝子治療に対する規制の検討(法の対象とする関連技術の範囲について) (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27055.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第79回 7/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
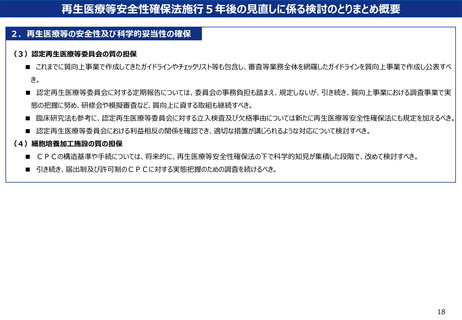
再生医療等安全性確保法施行5年後の見直しに係る検討のとりまとめ概要
1.医療技術等の変化への対応
(1)細胞加工物を用いない遺伝子治療(in vivo遺伝子治療)に対する規制の検討
<法の対象範囲とする遺伝子治療技術の範囲>
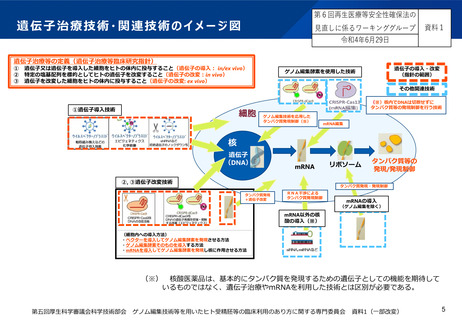
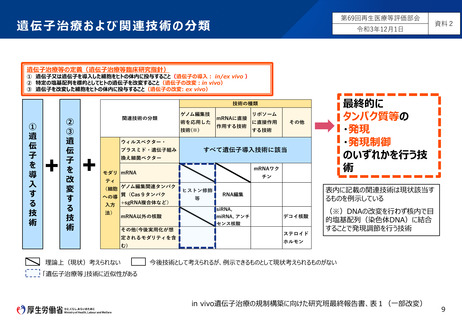
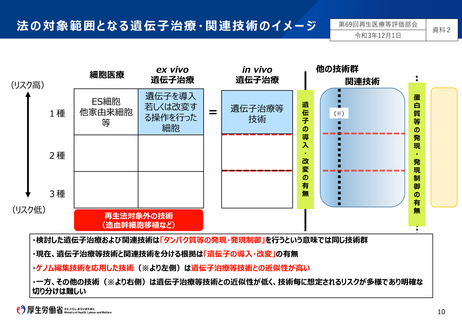
■ 遺伝子治療技術については、遺伝子治療等臨床研究指針で定義するin vivo遺伝子治療を含めた技術を法の範囲に含めるべき。
■ 今後の遺伝子治療及び関連技術の急速な進歩を見据え、技術やリスクが近似するものに対しても、迅速に対応できる法体系とすべき。
■ 関連技術については、遺伝子治療技術とリスクが近似する「ゲノム編集技術を応用した技術」を法の対象範囲とすべき。
■ mRNAを利用する技術については、法の対象範囲とするかどうか、技術とリスクの観点から、今後ワーキンググループ等で検討すべき。
<細胞医療と遺伝子治療の法的枠組みのあり方>
■ 従来の「細胞医療(ex vivo以外)+ex vivo遺伝子治療」の枠組みに加え、in vivo 遺伝子治療の法的枠組みを整備すべき。
■ また、細胞医療にもin vivo 遺伝子治療に近いリスクを抱えた技術が今後出現する場合に備え、例えば、in vivo 遺伝子治療で求められるものと同
等の手続を課すなど、その技術を想定した法的枠組みをあらかじめ設けておくことも考えられる。
<遺伝子治療の提供に求められる手続>
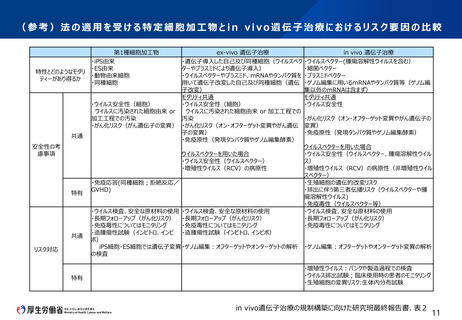
■ 現行の再生医療等安全性確保法の手続を前提とし、審査を行う委員会、遺伝子治療を提供する医療機関、ウイルスベクター等の製造・管理や取
扱業者において、遺伝子治療の提供に必要な手続を求めるべき。
■ ウイルスベクターの製造所や、細胞への遺伝子導入にウイルスベクターを使用するCPC、ウイルスベクター等を使用する医療機関において、再生医療
等安全性確保法上、追加的に求める要件はないが、作業者の健康管理等については、医療機関を含めたウイルスベクター製造所への注意喚起をQ
&A等で対応すべき。
<遺伝子治療・関連技術を用いたワクチンの扱い>
■ in vivo遺伝子治療のうち、疾病の予防を目的とするものについても、細胞医療(ex vivo遺伝子治療を含む)と同様に再生医療等安全性確保
法の対象とすべき。
■ 遺伝子治療・関連技術を用いたワクチンが、医薬品医療機器等法で医薬品として承認された場合、再生医療等製品と同様に再生医療等安全性
確保法の対象としないこととすべき。また、遺伝子治療・関連技術を用いたワクチンの治験については、細胞医療と同様に再生医療等安全確保法の対
象としないこととすべき。
■ 日本未承認であるが外国で承認されている感染症の予防(感染・発症予防や重症化予防等を含む)を目的としたワクチンについては、公衆衛生施
策上必要なものは再生医療等安全性確保法上、個別に除外することとすべき。
<疾病等報告について>
■ 遺伝子治療を再生医療等安全性確保法の対象とするにあたり、遺伝子治療の提供後に発生した事象の報告については、報告の実効性、現行法や
他法との整合性等を踏まえ、再生医療等安全性確保法で規定される疾病等とすべき。
15
1.医療技術等の変化への対応
(1)細胞加工物を用いない遺伝子治療(in vivo遺伝子治療)に対する規制の検討
<法の対象範囲とする遺伝子治療技術の範囲>
■ 遺伝子治療技術については、遺伝子治療等臨床研究指針で定義するin vivo遺伝子治療を含めた技術を法の範囲に含めるべき。
■ 今後の遺伝子治療及び関連技術の急速な進歩を見据え、技術やリスクが近似するものに対しても、迅速に対応できる法体系とすべき。
■ 関連技術については、遺伝子治療技術とリスクが近似する「ゲノム編集技術を応用した技術」を法の対象範囲とすべき。
■ mRNAを利用する技術については、法の対象範囲とするかどうか、技術とリスクの観点から、今後ワーキンググループ等で検討すべき。
<細胞医療と遺伝子治療の法的枠組みのあり方>
■ 従来の「細胞医療(ex vivo以外)+ex vivo遺伝子治療」の枠組みに加え、in vivo 遺伝子治療の法的枠組みを整備すべき。
■ また、細胞医療にもin vivo 遺伝子治療に近いリスクを抱えた技術が今後出現する場合に備え、例えば、in vivo 遺伝子治療で求められるものと同
等の手続を課すなど、その技術を想定した法的枠組みをあらかじめ設けておくことも考えられる。
<遺伝子治療の提供に求められる手続>
■ 現行の再生医療等安全性確保法の手続を前提とし、審査を行う委員会、遺伝子治療を提供する医療機関、ウイルスベクター等の製造・管理や取
扱業者において、遺伝子治療の提供に必要な手続を求めるべき。
■ ウイルスベクターの製造所や、細胞への遺伝子導入にウイルスベクターを使用するCPC、ウイルスベクター等を使用する医療機関において、再生医療
等安全性確保法上、追加的に求める要件はないが、作業者の健康管理等については、医療機関を含めたウイルスベクター製造所への注意喚起をQ
&A等で対応すべき。
<遺伝子治療・関連技術を用いたワクチンの扱い>
■ in vivo遺伝子治療のうち、疾病の予防を目的とするものについても、細胞医療(ex vivo遺伝子治療を含む)と同様に再生医療等安全性確保
法の対象とすべき。
■ 遺伝子治療・関連技術を用いたワクチンが、医薬品医療機器等法で医薬品として承認された場合、再生医療等製品と同様に再生医療等安全性
確保法の対象としないこととすべき。また、遺伝子治療・関連技術を用いたワクチンの治験については、細胞医療と同様に再生医療等安全確保法の対
象としないこととすべき。
■ 日本未承認であるが外国で承認されている感染症の予防(感染・発症予防や重症化予防等を含む)を目的としたワクチンについては、公衆衛生施
策上必要なものは再生医療等安全性確保法上、個別に除外することとすべき。
<疾病等報告について>
■ 遺伝子治療を再生医療等安全性確保法の対象とするにあたり、遺伝子治療の提供後に発生した事象の報告については、報告の実効性、現行法や
他法との整合性等を踏まえ、再生医療等安全性確保法で規定される疾病等とすべき。
15