よむ、つかう、まなぶ。
in vivo遺伝子治療に対する規制の検討(法の対象とする関連技術の範囲について) (18 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27055.html |
| 出典情報 | 厚生科学審議会 再生医療等評価部会(第79回 7/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
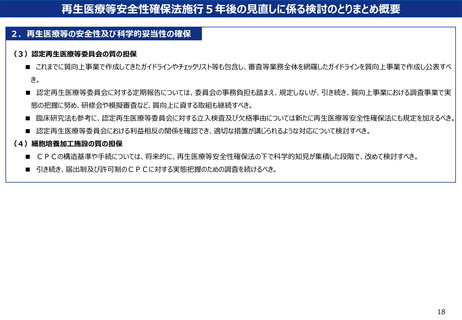
再生医療等安全性確保法施行5年後の見直しに係る検討のとりまとめ概要
2.再生医療等の安全性及び科学的妥当性の確保
(3)認定再生医療等委員会の質の担保
■ これまでに質向上事業で作成してきたガイドラインやチェックリスト等も包含し、審査等業務全体を網羅したガイドラインを質向上事業で作成し公表すべ
き。
■ 認定再生医療等委員会に対する定期報告については、委員会の事務負担も踏まえ、規定しないが、引き続き、質向上事業における調査事業で実
態の把握に努め、研修会や模擬審査など、質向上に資する取組も継続すべき。
■ 臨床研究法も参考に、認定再生医療等委員会に対する立入検査及び欠格事由については新たに再生医療等安全性確保法にも規定を加えるべき。
■ 認定再生医療等委員会における利益相反の関係を確認でき、適切な措置が講じられるような対応について検討すべき。
(4)細胞培養加工施設の質の担保
■ CPCの構造基準や手続については、将来的に、再生医療等安全性確保法の下で科学的知見が集積した段階で、改めて検討すべき。
■ 引き続き、届出制及び許可制のCPCに対する実態把握のための調査を続けるべき。
18
2.再生医療等の安全性及び科学的妥当性の確保
(3)認定再生医療等委員会の質の担保
■ これまでに質向上事業で作成してきたガイドラインやチェックリスト等も包含し、審査等業務全体を網羅したガイドラインを質向上事業で作成し公表すべ
き。
■ 認定再生医療等委員会に対する定期報告については、委員会の事務負担も踏まえ、規定しないが、引き続き、質向上事業における調査事業で実
態の把握に努め、研修会や模擬審査など、質向上に資する取組も継続すべき。
■ 臨床研究法も参考に、認定再生医療等委員会に対する立入検査及び欠格事由については新たに再生医療等安全性確保法にも規定を加えるべき。
■ 認定再生医療等委員会における利益相反の関係を確認でき、適切な措置が講じられるような対応について検討すべき。
(4)細胞培養加工施設の質の担保
■ CPCの構造基準や手続については、将来的に、再生医療等安全性確保法の下で科学的知見が集積した段階で、改めて検討すべき。
■ 引き続き、届出制及び許可制のCPCに対する実態把握のための調査を続けるべき。
18