よむ、つかう、まなぶ。
【資料No.1】1.7_同種同効品一覧表 (8 ページ)
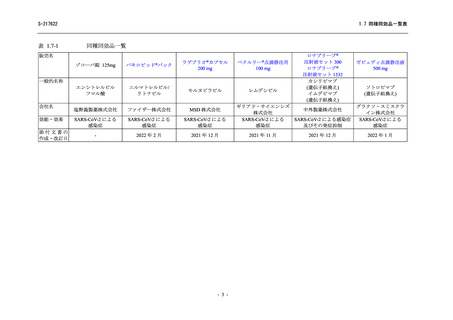
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
a)無作為化34日目のVisitにおいて、
無作為化28日目の評価を完了した場合は最終Visit時点で、
その前に試験中止又は追跡不能となった場合は最後に記録がある時点で打ち切りとした。
b)群 間 差 はKaplan-Meier法 に よ り 推 定 し た イ ベ ン ト 発 現 割 合 よ り 算 出 し、 分 散 は
Greenwoodの公式に基づき算出した。信頼区間は正規近似法により算出した。
c)Wald検定。有意水準両側0.2%、試験全体の有意水準は両側5%とし、中間解析による仮
説検定の多重性の調整方法としてO'Brien-Fleming型のα消費関数を用いた。
d)Wald検定
mITT集団:無作為化され、治験薬が1回以上投与され、ベースライン後から無作為化28日目
までに少なくとも1回のVisitがあり※、ベースライン時点でSARS-CoV-2による感
染症に対するモノクローナル抗体が投与されておらず投与の予定もなく、かつ、
SARS-CoV-2による感染症の症状発現から3日以内に治験薬が投与された被験者
mITT1集団:無作為化され、治験薬が1回以上投与され、ベースライン後から無作為化28日目
までに少なくとも1回のVisitがあり※、ベースライン時点でSARS-CoV-2による感
染症に対するモノクローナル抗体が投与されておらず投与の予定もない被験者
mITT2集団:無作為化され、治験薬が1回以上投与され、ベースライン後から無作為化28日
目までに少なくとも1回のVisitがある※被験者
※中間解析時点のみ、各解析対象集団の定義に「ベースライン後から無作為化28日目までに
少なくとも1回のVisitがある」を含めた。
16.7.2 臨床薬物相互作用試験
ニルマトレルビルをリトナビル併用下でイトラコナゾール(CYP3A阻害薬)又
はカルバマゼピン(CYP3A誘導薬)と併用投与したときのニルマトレルビル及
びリトナビルのCmax及びAUCに対する影響を評価した結果を以下に示す2,6)
(外
国人データ)
。
[10.、10.1、10.2参照]
カルバマゼピン又はイトラコナゾールがニルマトレルビル及びリトナビルの薬
物動態に及ぼす影響
薬物動態パラメータの比a)
(%)
(併用投与/単剤投与)
(90%信頼区間)
投与量
n
併用薬
ニルマトレルビ
ル/リトナビル
併用薬
300mg
カルバマ
300mg/100mg
1日2回
c)
ゼピン
単回投与
(16回投与)
イトラコ
ナゾール
200mg
300mg/100mg
1日1回
1日2回
(8回投与) (5回投与)
9
ニルマトレルビル
リトナビル
Cmax
AUCb)
Cmax
AUCb)
56.82
(47.04,
68.62)
44.50
(33.77,
58.65)
25.59
(18.76,
34.91)
16.57
(13.32,
20.60)
NC
NC
なお、本試験の主な選択・除外基準は表2のとおりであった。
118.57
138.82
11 (112.50, (129.25,
124.97)
149.11)
表2
a)影響がない場合は100(%)
b)カルバマゼピン:AUC=AUCinf、イトラコナゾール:AUC=AUCtau
c)カルバマゼピンは投与開始8日目から15日目まで1日2回300mgまで増量(1日目~3日目は
100mgを1日2回投与、4日目~7日目は200mgを1日2回投与)
NC:算出していない
主な選択・除外基準
選択基準
1.SARS-CoV-2陽性(無作為化前5日以内に採取された検体を用いたPCR検査
等により確認)
2.SARS-CoV-2による感染症の症状a)発現が無作為化前5日以内であり、かつ
無作為化時点においてSARS-CoV-2による感染症の症状a)が1つ以上認めら
れる
3.次のSARS-CoV-2による感染症の重症化リスク因子を少なくとも1つ有する
・60歳以上
・BMI 25kg/m2超
・喫煙者(過去30日以内の喫煙があり、かつ生涯に100本以上の喫煙がある)
・免疫抑制疾患b)又は免疫抑制剤の継続投与c)
・慢性肺疾患(喘息は、処方薬の連日投与を要する場合のみ)
・高血圧の診断を受けている
・心血管系疾患(心筋梗塞、脳卒中、一過性脳虚血発作、心不全、ニトロ
グリセリンが処方された狭心症、冠動脈バイパス術、経皮的冠動脈形成術、
頚動脈内膜剥離術又は大動脈バイパス術の既往を有する)
・1型又は2型糖尿病
・慢性腎臓病
・鎌状赤血球症
・神経発達障害(脳性麻痺、ダウン症候群等)又は医学的複雑性を付与する
その他の疾患(遺伝性疾患、メタボリックシンドローム、重度の先天異常等)
・限局性皮膚がんを除く活動性のがん
・医療技術への依存(SARS-CoV-2による感染症と無関係な持続陽圧呼吸
療法等)
除外基準
1.SARS-CoV-2による感染症の治療のための入院歴がある
2.入院が必要な状態又は無作為化後48時間以内に入院が必要になることが想
定される
3.現在の感染より前に、抗原又は核酸検出検査によりSARS-CoV-2感染が確
認されたことがある
4.活動性の肝疾患(慢性又は活動性のB型又はC型肝炎ウイルス感染、原発性
胆汁性肝硬変、Child-PughクラスB又はC、急性肝不全を含む活動性肝疾患
等。非アルコール性脂肪肝は除く)の既往歴を有する
5.透析中又は中等度から重度の腎機能障害(スクリーニング前6カ月以内の血清
クレアチニン値に基づくCKD-EPI式で算出されたeGFRが45mL/min/1.73m2
未満)を有する
6.ウイルス量が400copies/mL超のHIV感染症患者又はHIV感染症の治療のた
めに併用禁止薬を使用しているHIV感染症患者
7.SARS-CoV-2による感染症に対するワクチン接種歴を有する又は無作為化
34日目より前に接種を受けることが予想されている
8.無作為化前24時間以内の酸素飽和度が92%未満(安静時、室内気)d)
注)本剤の承認された用法及び用量は、ニルマトレルビル300mg及びリトナビル100mgを
同時に1日2回経口投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第Ⅱ/Ⅲ相試験[C4671005(EPIC-HR)試験]
18歳 以 上 のSARS-CoV-2による 感 染 症 患 者 を 対 象 に、ニ ル マトレ ル ビ ル
300mg及びリトナビル100mgを併用で1日2回5日間投与したときの有効性及び
安全性を評価することを目的としたプラセボ対照無作為化二重盲検並行群間
比較試験を実施した。主要評価項目は無作為化28日目までのSARS-CoV-2に
よる感染症に関連のある入院又は理由を問わない死亡のイベントが認められ
た被験者の割合とした。主要な解析である中間解析(2021年10月26日データ
カットオフ)では1361例(日本人1例)が無作為化され、主要評価項目(mITT
集団)の結果は、ニルマトレルビル及びリトナビル併用群0.8%(3/389例)並
びにプラセボ群7.0%(27/385例)であり、割合の群間差は-6.317%[95%信
頼区間:-9.041,-3.593]であった(表1)
。内訳は、ニルマトレルビル及び
リトナビル併用群で入院3/389例(0.8%)
、死亡0/389例(0%)であり、プラ
セボ群で入院27/385例(7.0%)
、死亡7/385例(1.8%)であった。なお、無作
為化されたすべての被験者2246例(日本人6例)における補足的な解析での主
要評価項目(mITT集団)の結果は、ニルマトレルビル及びリトナビル併用群
0.7%(5/697例)並びにプラセボ群6.5%(44/682例)であり、割合の群間差
は-5.807%[95%信頼区間:-7.777,-3.837]であった(表1)
。内訳は、ニル
マトレルビル及びリトナビル併用群で入院5/697例(0.7%)
、
死亡0/697例(0%)
であり、プラセボ群で入院44/682例(6.5%)
、死亡9/682例(1.3%)であった。
表1 主要評価項目の結果
中間解析結果
イベント発現割合
mITT集団
プラセボ群との差
[95%信頼区間]a)b)
ニルマトレルビル及び
リトナビル併用群
プラセボ群
0.8%(3/389例)
7.0%(27/385例)
-6.317%[-9.041%, -3.593%]
a)b)c)
p値
イベント発現割合
mITT1集団
プラセボ群との差
[95%信頼区間]a)b)
イベント発現割合
mITT2集団
プラセボ群との差
[95%信頼区間]a)b)
a)咳、息切れ又は呼吸困難、発熱(38℃超)又は熱っぽさ等、悪寒又は震え、疲労、筋肉
又は体の痛み、下痢、悪心、嘔吐、頭痛、咽頭痛、鼻詰まり又は鼻水
b)骨髄移植、臓器移植、原発性免疫不全症、CD4陽性細胞数が200/μL未満かつウイルス量
が400copies/mL未満のHIV感染症患者等
c)試験組入れ前30日以内に14日以上連続でプレドニゾン20mg/日以上に相当するコルチコ
ステロイドの投与、試験組入れ前90日以内に生物製剤(インフリキシマブ、ウステキヌ
マブ等)若しくは免疫調節薬(メトトレキサート、メルカプトプリン、アザチオプリン等)
の投与、又はがん化学療法を受けた場合
d)肺に基礎疾患を有し、長期的に酸素投与を受けている場合は、日常的に受けている在宅
酸素療法下における値
<0.0001
1.0%(6/607例)
6.7%(41/612例)
-5.765%[-7.917%, -3.613%]
1.1%(7/661例)
6.4%(43/669例)
中間解析時点の副作用発現頻度は、ニルマトレルビル及びリトナビル併用群
で7.3%(49/672例)であり、主な副作用は、味覚不全(3.7%、25/672例)
-5.425%[-7.460%, -3.390%]
及び下痢(1.9%、13/672例)であった11)。[5.1、7.1参照]
中間解析の後に実施した、無作為化されたすべての被験者での解析結果
イベント発現割合
mITT集団
プラセボ群との差
[95%信頼区間]a)b)
a)b)d)
p値
イベント発現割合
mITT1集団
プラセボ群との差
[95%信頼区間]a)b)
イベント発現割合
mITT2集団
プラセボ群との差
[95%信頼区間]a)b)
ニルマトレルビル及び
リトナビル併用群
プラセボ群
0.717%(5/697例)
6.452%(44/682例)
18. 薬効薬理
18.1 作用機序
ニルマトレルビルはSARS-CoV-2のメインプロテアーゼ(Mpro:3CLプロテ
アーゼ又はnsp5とも呼ばれる)を阻害し(IC50=19.2nmol/L)、ポリタンパク
-5.807%[-7.777%, -3.837%]
質の切断を阻止することで、ウイルス複製を抑制する。
リトナビルは検討した最高濃度(3μmol/L)までSARS-CoV-2に対して抗ウ
<0.0001
0.770%(8/1039例)
イルス活性を示さなかった。リトナビルはニルマトレルビルのCYP3Aによる
6.310%(66/1046例)
代謝を阻害し、血漿中濃度を増加させる。
-5.619%[-7.207%, -4.031%]
0.812%(9/1109例)
18.2 In vitro 抗ウイルス活性
ニルマトレルビルは細胞培養系を用いた試験において、SARS-CoV-2臨床分
6.099%(68/1115例)
離株(USA-WA1/2020株)に対して抗ウイルス活性を示した(dNHBE細胞注)
:
-5.363%[-6.884%, -3.842%]
EC50 61.8nmol/L)。
5
無作為化28日目の評価を完了した場合は最終Visit時点で、
その前に試験中止又は追跡不能となった場合は最後に記録がある時点で打ち切りとした。
b)群 間 差 はKaplan-Meier法 に よ り 推 定 し た イ ベ ン ト 発 現 割 合 よ り 算 出 し、 分 散 は
Greenwoodの公式に基づき算出した。信頼区間は正規近似法により算出した。
c)Wald検定。有意水準両側0.2%、試験全体の有意水準は両側5%とし、中間解析による仮
説検定の多重性の調整方法としてO'Brien-Fleming型のα消費関数を用いた。
d)Wald検定
mITT集団:無作為化され、治験薬が1回以上投与され、ベースライン後から無作為化28日目
までに少なくとも1回のVisitがあり※、ベースライン時点でSARS-CoV-2による感
染症に対するモノクローナル抗体が投与されておらず投与の予定もなく、かつ、
SARS-CoV-2による感染症の症状発現から3日以内に治験薬が投与された被験者
mITT1集団:無作為化され、治験薬が1回以上投与され、ベースライン後から無作為化28日目
までに少なくとも1回のVisitがあり※、ベースライン時点でSARS-CoV-2による感
染症に対するモノクローナル抗体が投与されておらず投与の予定もない被験者
mITT2集団:無作為化され、治験薬が1回以上投与され、ベースライン後から無作為化28日
目までに少なくとも1回のVisitがある※被験者
※中間解析時点のみ、各解析対象集団の定義に「ベースライン後から無作為化28日目までに
少なくとも1回のVisitがある」を含めた。
16.7.2 臨床薬物相互作用試験
ニルマトレルビルをリトナビル併用下でイトラコナゾール(CYP3A阻害薬)又
はカルバマゼピン(CYP3A誘導薬)と併用投与したときのニルマトレルビル及
びリトナビルのCmax及びAUCに対する影響を評価した結果を以下に示す2,6)
(外
国人データ)
。
[10.、10.1、10.2参照]
カルバマゼピン又はイトラコナゾールがニルマトレルビル及びリトナビルの薬
物動態に及ぼす影響
薬物動態パラメータの比a)
(%)
(併用投与/単剤投与)
(90%信頼区間)
投与量
n
併用薬
ニルマトレルビ
ル/リトナビル
併用薬
300mg
カルバマ
300mg/100mg
1日2回
c)
ゼピン
単回投与
(16回投与)
イトラコ
ナゾール
200mg
300mg/100mg
1日1回
1日2回
(8回投与) (5回投与)
9
ニルマトレルビル
リトナビル
Cmax
AUCb)
Cmax
AUCb)
56.82
(47.04,
68.62)
44.50
(33.77,
58.65)
25.59
(18.76,
34.91)
16.57
(13.32,
20.60)
NC
NC
なお、本試験の主な選択・除外基準は表2のとおりであった。
118.57
138.82
11 (112.50, (129.25,
124.97)
149.11)
表2
a)影響がない場合は100(%)
b)カルバマゼピン:AUC=AUCinf、イトラコナゾール:AUC=AUCtau
c)カルバマゼピンは投与開始8日目から15日目まで1日2回300mgまで増量(1日目~3日目は
100mgを1日2回投与、4日目~7日目は200mgを1日2回投与)
NC:算出していない
主な選択・除外基準
選択基準
1.SARS-CoV-2陽性(無作為化前5日以内に採取された検体を用いたPCR検査
等により確認)
2.SARS-CoV-2による感染症の症状a)発現が無作為化前5日以内であり、かつ
無作為化時点においてSARS-CoV-2による感染症の症状a)が1つ以上認めら
れる
3.次のSARS-CoV-2による感染症の重症化リスク因子を少なくとも1つ有する
・60歳以上
・BMI 25kg/m2超
・喫煙者(過去30日以内の喫煙があり、かつ生涯に100本以上の喫煙がある)
・免疫抑制疾患b)又は免疫抑制剤の継続投与c)
・慢性肺疾患(喘息は、処方薬の連日投与を要する場合のみ)
・高血圧の診断を受けている
・心血管系疾患(心筋梗塞、脳卒中、一過性脳虚血発作、心不全、ニトロ
グリセリンが処方された狭心症、冠動脈バイパス術、経皮的冠動脈形成術、
頚動脈内膜剥離術又は大動脈バイパス術の既往を有する)
・1型又は2型糖尿病
・慢性腎臓病
・鎌状赤血球症
・神経発達障害(脳性麻痺、ダウン症候群等)又は医学的複雑性を付与する
その他の疾患(遺伝性疾患、メタボリックシンドローム、重度の先天異常等)
・限局性皮膚がんを除く活動性のがん
・医療技術への依存(SARS-CoV-2による感染症と無関係な持続陽圧呼吸
療法等)
除外基準
1.SARS-CoV-2による感染症の治療のための入院歴がある
2.入院が必要な状態又は無作為化後48時間以内に入院が必要になることが想
定される
3.現在の感染より前に、抗原又は核酸検出検査によりSARS-CoV-2感染が確
認されたことがある
4.活動性の肝疾患(慢性又は活動性のB型又はC型肝炎ウイルス感染、原発性
胆汁性肝硬変、Child-PughクラスB又はC、急性肝不全を含む活動性肝疾患
等。非アルコール性脂肪肝は除く)の既往歴を有する
5.透析中又は中等度から重度の腎機能障害(スクリーニング前6カ月以内の血清
クレアチニン値に基づくCKD-EPI式で算出されたeGFRが45mL/min/1.73m2
未満)を有する
6.ウイルス量が400copies/mL超のHIV感染症患者又はHIV感染症の治療のた
めに併用禁止薬を使用しているHIV感染症患者
7.SARS-CoV-2による感染症に対するワクチン接種歴を有する又は無作為化
34日目より前に接種を受けることが予想されている
8.無作為化前24時間以内の酸素飽和度が92%未満(安静時、室内気)d)
注)本剤の承認された用法及び用量は、ニルマトレルビル300mg及びリトナビル100mgを
同時に1日2回経口投与である。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国際共同第Ⅱ/Ⅲ相試験[C4671005(EPIC-HR)試験]
18歳 以 上 のSARS-CoV-2による 感 染 症 患 者 を 対 象 に、ニ ル マトレ ル ビ ル
300mg及びリトナビル100mgを併用で1日2回5日間投与したときの有効性及び
安全性を評価することを目的としたプラセボ対照無作為化二重盲検並行群間
比較試験を実施した。主要評価項目は無作為化28日目までのSARS-CoV-2に
よる感染症に関連のある入院又は理由を問わない死亡のイベントが認められ
た被験者の割合とした。主要な解析である中間解析(2021年10月26日データ
カットオフ)では1361例(日本人1例)が無作為化され、主要評価項目(mITT
集団)の結果は、ニルマトレルビル及びリトナビル併用群0.8%(3/389例)並
びにプラセボ群7.0%(27/385例)であり、割合の群間差は-6.317%[95%信
頼区間:-9.041,-3.593]であった(表1)
。内訳は、ニルマトレルビル及び
リトナビル併用群で入院3/389例(0.8%)
、死亡0/389例(0%)であり、プラ
セボ群で入院27/385例(7.0%)
、死亡7/385例(1.8%)であった。なお、無作
為化されたすべての被験者2246例(日本人6例)における補足的な解析での主
要評価項目(mITT集団)の結果は、ニルマトレルビル及びリトナビル併用群
0.7%(5/697例)並びにプラセボ群6.5%(44/682例)であり、割合の群間差
は-5.807%[95%信頼区間:-7.777,-3.837]であった(表1)
。内訳は、ニル
マトレルビル及びリトナビル併用群で入院5/697例(0.7%)
、
死亡0/697例(0%)
であり、プラセボ群で入院44/682例(6.5%)
、死亡9/682例(1.3%)であった。
表1 主要評価項目の結果
中間解析結果
イベント発現割合
mITT集団
プラセボ群との差
[95%信頼区間]a)b)
ニルマトレルビル及び
リトナビル併用群
プラセボ群
0.8%(3/389例)
7.0%(27/385例)
-6.317%[-9.041%, -3.593%]
a)b)c)
p値
イベント発現割合
mITT1集団
プラセボ群との差
[95%信頼区間]a)b)
イベント発現割合
mITT2集団
プラセボ群との差
[95%信頼区間]a)b)
a)咳、息切れ又は呼吸困難、発熱(38℃超)又は熱っぽさ等、悪寒又は震え、疲労、筋肉
又は体の痛み、下痢、悪心、嘔吐、頭痛、咽頭痛、鼻詰まり又は鼻水
b)骨髄移植、臓器移植、原発性免疫不全症、CD4陽性細胞数が200/μL未満かつウイルス量
が400copies/mL未満のHIV感染症患者等
c)試験組入れ前30日以内に14日以上連続でプレドニゾン20mg/日以上に相当するコルチコ
ステロイドの投与、試験組入れ前90日以内に生物製剤(インフリキシマブ、ウステキヌ
マブ等)若しくは免疫調節薬(メトトレキサート、メルカプトプリン、アザチオプリン等)
の投与、又はがん化学療法を受けた場合
d)肺に基礎疾患を有し、長期的に酸素投与を受けている場合は、日常的に受けている在宅
酸素療法下における値
<0.0001
1.0%(6/607例)
6.7%(41/612例)
-5.765%[-7.917%, -3.613%]
1.1%(7/661例)
6.4%(43/669例)
中間解析時点の副作用発現頻度は、ニルマトレルビル及びリトナビル併用群
で7.3%(49/672例)であり、主な副作用は、味覚不全(3.7%、25/672例)
-5.425%[-7.460%, -3.390%]
及び下痢(1.9%、13/672例)であった11)。[5.1、7.1参照]
中間解析の後に実施した、無作為化されたすべての被験者での解析結果
イベント発現割合
mITT集団
プラセボ群との差
[95%信頼区間]a)b)
a)b)d)
p値
イベント発現割合
mITT1集団
プラセボ群との差
[95%信頼区間]a)b)
イベント発現割合
mITT2集団
プラセボ群との差
[95%信頼区間]a)b)
ニルマトレルビル及び
リトナビル併用群
プラセボ群
0.717%(5/697例)
6.452%(44/682例)
18. 薬効薬理
18.1 作用機序
ニルマトレルビルはSARS-CoV-2のメインプロテアーゼ(Mpro:3CLプロテ
アーゼ又はnsp5とも呼ばれる)を阻害し(IC50=19.2nmol/L)、ポリタンパク
-5.807%[-7.777%, -3.837%]
質の切断を阻止することで、ウイルス複製を抑制する。
リトナビルは検討した最高濃度(3μmol/L)までSARS-CoV-2に対して抗ウ
<0.0001
0.770%(8/1039例)
イルス活性を示さなかった。リトナビルはニルマトレルビルのCYP3Aによる
6.310%(66/1046例)
代謝を阻害し、血漿中濃度を増加させる。
-5.619%[-7.207%, -4.031%]
0.812%(9/1109例)
18.2 In vitro 抗ウイルス活性
ニルマトレルビルは細胞培養系を用いた試験において、SARS-CoV-2臨床分
6.099%(68/1115例)
離株(USA-WA1/2020株)に対して抗ウイルス活性を示した(dNHBE細胞注)
:
-5.363%[-6.884%, -3.842%]
EC50 61.8nmol/L)。
5