よむ、つかう、まなぶ。
【資料No.1】1.7_同種同効品一覧表 (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
18. 薬効薬理
*18.1 作用機序
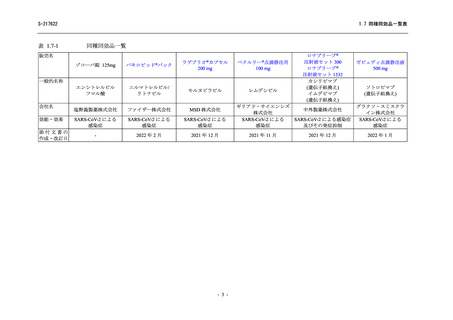
なお、本試験の主な選択・除外基準は下表のとおりであった。
主な選択・除外基準
選択基準
除外基準
1.無作為化前4日以内に実施したPCR検査においてSARSCoV-2感染が確認されている
2.入院中
3.ス クリーニング時に、SpO2が94%以下(室内気)又は
酸素吸入を要する
4.画像上、肺浸潤影が認められる
1.多臓器不全
2.人 工呼吸器(V-V ECMOを含む)を5日間以上使用、
又はV-AECMOを使用(使用期間を問わない)
3.ALT又はASTが基準範囲上限の5倍超
4.クレアチニン・クリアランスが50mL/min未満(18歳以
上の場合はCockcroft-Gault式、18歳未満の場合は
Schwartz式を用いて算出)
5.妊娠検査陽性
6.授乳中
副作用が認められた被験者の割合は、5日間投与群及び10日間投与群でそ
れぞれ17%(33/200例)及び20%(40/197例)であった。主な副作用は、
ALT増加(5日間投与群で2%(4/200例)、10日間投与群で7%(14/197
例))、AST増加(5日間投与群で3%(5/200例)、10日間投与群で6%
(11/197例))及び悪心(5日間投与群で5%(9/200例)、10日間投与群で
3%(5/197例))であった。
(3)GS-US-540-5774試験(NCT04292730)
12歳以上18歳未満かつ体重40kg以上、及び18歳以上の中等症のSARSCoV-2による感染症患者(584例、なお、日本人被験者は組み入れられ
なかった)を対象とした無作為化非盲検並行群間比較パートにおいて、5
日間投与群では、投与初日に本剤200mgを、2~5日目に100mgを1日1回
静脈内投与、10日間投与群では、投与初日に本剤200mgを、2~10日目に
100mgを1日1回静脈内投与し、標準療法群と比較した 6)、7)。なお、退院
した場合は治験薬投与を中止することとされた。いずれの本剤投与群も
標準療法の併用を受けた。主要評価項目は、無作為化後10日目に7点順序
尺度 注3)で評価した臨床状態とされた。臨床状態の改善について、比例
オッズモデルに基づく標準療法群に対する各本剤投与群の比例オッズ比
[95%信頼区間]は、5日間投与群で1.65[1.09, 2.48, p=0.017]、10日
間投与群では1.31[0.88,1.95,p=0.18]であった。
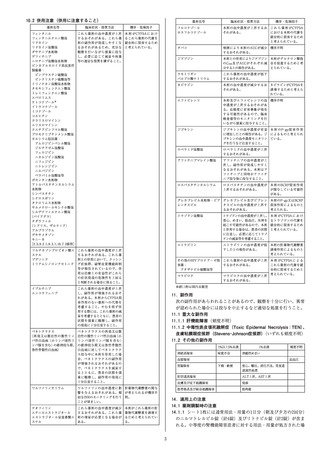
表2
無作為化後10日目における臨床状態(7点順序尺度)
スコア
5日間投与群
(191例)
0
0
5(2.6)
7(3.7)
38(19.9)
7(3.7)
134(70.2)
10日間投与群
(193例)
2(1.0)
1(0.5)
0
12(6.2)
44(22.8)
9(4.7)
125(64.8)
1
2
3
4
5
6
7
SOC群に対する
1.65
1.31
比例オッズ比
a) [1.092,2.483] [0.880,1.952]
[95%信頼区間]
0.0174
0.1826
p値b)
SOC群
(200例)
4(2.0)
4(2.0)
7(3.5)
11(5.5)
46(23.0)
8(4.0)
120(60.0)
-
例数(%)、-:該当なし
a)投与群を共変量とした比例オッズモデル
b)試験全体の有意水準を両側5%、仮説検定の多重性を調整する方法としてBonferroni
の方法を用いて各比較における有意水準を両側2.5%とした。
レムデシビルはアデノシンヌクレオシド類似体のプロドラッグである。
レムデシビルは、細胞内に分布し、加水分解による代謝を経て、最終的
にリン酸化されて薬理学的に活性を有するヌクレオシド三リン酸型の活
性代謝物を生成する。活性代謝物はアデノシン三リン酸(ATP)の類似
体として、SARS-CoV-2 RNA依存性RNAポリメラーゼによって新たに
合成されるRNA鎖に天然基質ATPと競合して取り込まれ、ウイルスの複
製におけるRNA鎖の伸長反応を取り込みから少し遅れて停止させる。活
性代謝物は、ヒト由来のDNAポリメラーゼα、β及びRNAポリメラー
ゼⅡ、並びにミトコンドリアDNAポリメラーゼγ及びミトコンドリア
RNAポリメラーゼに対する阻害作用(IC 50値)はいずれも>200μMで
あった。
**18.2 In vitro抗ウイルス活性
*
レムデシビルは、SARS-CoV-2の臨床分離株に対して、薬剤添加48時間
後におけるヒト初代培養気道上皮細胞での50%有効濃度(EC 50 )は
9.9nMであった。また、継代培養ヒト肺上皮細胞株Calu-3及びA549hACE2でSARS-CoV-2の複製を阻害し、EC50は薬剤添加72時間後及び
48時間後でそれぞれ280nM及び115nMであった 8)、9)。なお、ウイルス
RNA依存性RNAポリメラーゼを構成するNsp12のアミノ酸置換P323Lを
含むSARS-CoV-2変異体の臨床分離株(alpha株(B.1.1.7系統)、beta
株(B.1.351系統)、delta株(B.1.617.2系統)、gamma株(P.1系統)
及びepsilon株(B.1.429系統))に対するプラークアッセイ及び/又はN
タンパク質ELISAアッセイでは、これら臨床分離株のEC 50 は初期の
SARS-CoV-2の系統(A系統)と比較して0.4~1.5倍であった10)。
**18.3 薬剤耐性
レムデシビル耐性のSARS-CoV-2出現に関する臨床データは得られてい
ない。培養細胞系では、レムデシビルに対する感受性が低下したSARSCoV-2分離株が確認された。GS-441524(レムデシビルの代謝物である
ヌクレオシド類似体)を用いた耐性発現試験において、レムデシビルに
対する耐性変異としてNsp12のアミノ酸置換V166A、N198S、S759A、
V792I、C799F及びC799Rが同定された。各置換を導入した組換え
SARS-CoV-2では、レムデシビルに対して1.7~3.5倍の感受性低下を示
した11)。Nsp12のアミノ酸置換P323Lを有するSARS-CoV-2分離株を用
いたレムデシビルによる耐性発現試験では、Nsp12のアミノ酸置換
V166Lが同定された。P323L単独又はP323L+V166L重複置換を導入した
組換えSARS-CoV-2では、レムデシビルに対してそれぞれ1.3倍及び1.5
倍の感受性変化を示した12)。げっ歯類CoVのマウス肝炎ウイルスを用い
たレムデシビルのin vitro耐性解析では、RNA依存性RNAポリメラーゼ
で全てのCoVに保存された残基において、2カ所の変異(F476L及び
V553L)が確認され、レムデシビルに対して5.6倍の感受性低下を示した。
この変異体はin vitroでウイルス複製能が低下した。同様の変異
(F480L及びV557L)をSARS-CoVに導入したとき、培養細胞内でレムデ
シビルに対して6倍の感受性低下を示し、SARS-CoV感染マウスモデル
においてウイルスの病原性が減弱した。また、Nsp12にF480L及びV557L
の各変異を導入した組換えSARS-CoV-2では、レムデシビルに対して2
倍の感受性低下を示した11)。
*18.4 動物モデルにおける治療効果
SARS-CoV-2接種12時間後のアカゲザルSARS-CoV-2感染モデルに、
投与初日はレムデシビル10mg/kgで1日1回、その後は5mg/kgで1日1回
を静脈内ボーラス投与したところ、溶媒対照と比較して、呼吸器系疾患
の臨床徴候が改善し、肺病理像及び肺病変所見並びに肺ウイルスRNA量
が減少した。
なお、本試験の主な選択・除外基準は下表のとおりであった。
19. 有効成分に関する理化学的知見
主な選択・除外基準
選択基準
除外基準
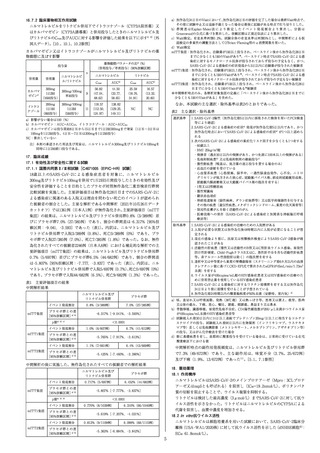
一般的名称:レムデシビル(Remdesivir)
化学名:2-EthylbutylN-{(S)-[2-C-(4-aminopyrrolo[2,1-f][1,2,4]
triazin-7-yl)-2,5-anhydro-D-altrononitril-6-O-yl]
phenoxyphosphoryl}-L-alaninate
分子式:C27H35N6O8P
分子量:602.58
化学構造式:
1.無作為化前4日以内に実施したPCR検査においてSARSCoV-2感染が確認されている
2.入院中であり、COVID-19に対する治療を要する
3.スクリーニング時に、SpO2が94%超(室内気)
4.画像上、肺浸潤影が認められる
1.スクリーニング時に人工呼吸器の使用を要する
2.ALT又はASTが基準範囲上限の5倍超
3.クレアチニン・クリアランスが50mL/min未満(18歳以
上の場合はCockcroft-Gault式、18歳未満の場合は
Schwartz式を用いて算出)
4.妊娠検査陽性
5.授乳中
副作用が認められた被験者の割合は、5日間投与群及び10日間投与群でそ
れぞれ19%(36/191例)及び13%(25/193例)であった。主な副作用は、
悪心(5日間投与群で7%(13/191例)、10日間投与群で4%(7/193例))
であった。
注3)7点順序尺度[スコア1:死亡、2:入院かつECMO又は侵襲的人工
呼吸器による管理、3:入院かつ非侵襲的換気又は高流量酸素による
管理、4:入院かつ低流量酸素による管理、5:入院しており、酸素
吸入を要しないがSARS-CoV-2による感染症に関わらず継続的な治
療を要する、6:入院しており、酸素吸入及び継続的な治療は要しな
い(ただし、プロトコルに従った本剤の投与は除く)
、7:退院]
性 状:白色~微黄白色又は黄色の固体
溶解性:メタノール、テトラヒドロフランに溶けやすく、エタノールに
やや溶けやすく、酢酸イソプロピルに溶けにくい。
融 点:138℃
分配係数:logP=3.2
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
-4-
*18.1 作用機序
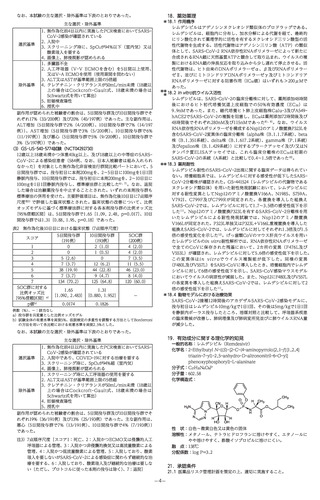
なお、本試験の主な選択・除外基準は下表のとおりであった。
主な選択・除外基準
選択基準
除外基準
1.無作為化前4日以内に実施したPCR検査においてSARSCoV-2感染が確認されている
2.入院中
3.ス クリーニング時に、SpO2が94%以下(室内気)又は
酸素吸入を要する
4.画像上、肺浸潤影が認められる
1.多臓器不全
2.人 工呼吸器(V-V ECMOを含む)を5日間以上使用、
又はV-AECMOを使用(使用期間を問わない)
3.ALT又はASTが基準範囲上限の5倍超
4.クレアチニン・クリアランスが50mL/min未満(18歳以
上の場合はCockcroft-Gault式、18歳未満の場合は
Schwartz式を用いて算出)
5.妊娠検査陽性
6.授乳中
副作用が認められた被験者の割合は、5日間投与群及び10日間投与群でそ
れぞれ17%(33/200例)及び20%(40/197例)であった。主な副作用は、
ALT増加(5日間投与群で2%(4/200例)、10日間投与群で7%(14/197
例))、AST増加(5日間投与群で3%(5/200例)、10日間投与群で6%
(11/197例))及び悪心(5日間投与群で5%(9/200例)、10日間投与群で
3%(5/197例))であった。
(3)GS-US-540-5774試験(NCT04292730)
12歳以上18歳未満かつ体重40kg以上、及び18歳以上の中等症のSARSCoV-2による感染症患者(584例、なお、日本人被験者は組み入れられ
なかった)を対象とした無作為化非盲検並行群間比較パートにおいて、5
日間投与群では、投与初日に本剤200mgを、2~5日目に100mgを1日1回
静脈内投与、10日間投与群では、投与初日に本剤200mgを、2~10日目に
100mgを1日1回静脈内投与し、標準療法群と比較した 6)、7)。なお、退院
した場合は治験薬投与を中止することとされた。いずれの本剤投与群も
標準療法の併用を受けた。主要評価項目は、無作為化後10日目に7点順序
尺度 注3)で評価した臨床状態とされた。臨床状態の改善について、比例
オッズモデルに基づく標準療法群に対する各本剤投与群の比例オッズ比
[95%信頼区間]は、5日間投与群で1.65[1.09, 2.48, p=0.017]、10日
間投与群では1.31[0.88,1.95,p=0.18]であった。
表2
無作為化後10日目における臨床状態(7点順序尺度)
スコア
5日間投与群
(191例)
0
0
5(2.6)
7(3.7)
38(19.9)
7(3.7)
134(70.2)
10日間投与群
(193例)
2(1.0)
1(0.5)
0
12(6.2)
44(22.8)
9(4.7)
125(64.8)
1
2
3
4
5
6
7
SOC群に対する
1.65
1.31
比例オッズ比
a) [1.092,2.483] [0.880,1.952]
[95%信頼区間]
0.0174
0.1826
p値b)
SOC群
(200例)
4(2.0)
4(2.0)
7(3.5)
11(5.5)
46(23.0)
8(4.0)
120(60.0)
-
例数(%)、-:該当なし
a)投与群を共変量とした比例オッズモデル
b)試験全体の有意水準を両側5%、仮説検定の多重性を調整する方法としてBonferroni
の方法を用いて各比較における有意水準を両側2.5%とした。
レムデシビルはアデノシンヌクレオシド類似体のプロドラッグである。
レムデシビルは、細胞内に分布し、加水分解による代謝を経て、最終的
にリン酸化されて薬理学的に活性を有するヌクレオシド三リン酸型の活
性代謝物を生成する。活性代謝物はアデノシン三リン酸(ATP)の類似
体として、SARS-CoV-2 RNA依存性RNAポリメラーゼによって新たに
合成されるRNA鎖に天然基質ATPと競合して取り込まれ、ウイルスの複
製におけるRNA鎖の伸長反応を取り込みから少し遅れて停止させる。活
性代謝物は、ヒト由来のDNAポリメラーゼα、β及びRNAポリメラー
ゼⅡ、並びにミトコンドリアDNAポリメラーゼγ及びミトコンドリア
RNAポリメラーゼに対する阻害作用(IC 50値)はいずれも>200μMで
あった。
**18.2 In vitro抗ウイルス活性
*
レムデシビルは、SARS-CoV-2の臨床分離株に対して、薬剤添加48時間
後におけるヒト初代培養気道上皮細胞での50%有効濃度(EC 50 )は
9.9nMであった。また、継代培養ヒト肺上皮細胞株Calu-3及びA549hACE2でSARS-CoV-2の複製を阻害し、EC50は薬剤添加72時間後及び
48時間後でそれぞれ280nM及び115nMであった 8)、9)。なお、ウイルス
RNA依存性RNAポリメラーゼを構成するNsp12のアミノ酸置換P323Lを
含むSARS-CoV-2変異体の臨床分離株(alpha株(B.1.1.7系統)、beta
株(B.1.351系統)、delta株(B.1.617.2系統)、gamma株(P.1系統)
及びepsilon株(B.1.429系統))に対するプラークアッセイ及び/又はN
タンパク質ELISAアッセイでは、これら臨床分離株のEC 50 は初期の
SARS-CoV-2の系統(A系統)と比較して0.4~1.5倍であった10)。
**18.3 薬剤耐性
レムデシビル耐性のSARS-CoV-2出現に関する臨床データは得られてい
ない。培養細胞系では、レムデシビルに対する感受性が低下したSARSCoV-2分離株が確認された。GS-441524(レムデシビルの代謝物である
ヌクレオシド類似体)を用いた耐性発現試験において、レムデシビルに
対する耐性変異としてNsp12のアミノ酸置換V166A、N198S、S759A、
V792I、C799F及びC799Rが同定された。各置換を導入した組換え
SARS-CoV-2では、レムデシビルに対して1.7~3.5倍の感受性低下を示
した11)。Nsp12のアミノ酸置換P323Lを有するSARS-CoV-2分離株を用
いたレムデシビルによる耐性発現試験では、Nsp12のアミノ酸置換
V166Lが同定された。P323L単独又はP323L+V166L重複置換を導入した
組換えSARS-CoV-2では、レムデシビルに対してそれぞれ1.3倍及び1.5
倍の感受性変化を示した12)。げっ歯類CoVのマウス肝炎ウイルスを用い
たレムデシビルのin vitro耐性解析では、RNA依存性RNAポリメラーゼ
で全てのCoVに保存された残基において、2カ所の変異(F476L及び
V553L)が確認され、レムデシビルに対して5.6倍の感受性低下を示した。
この変異体はin vitroでウイルス複製能が低下した。同様の変異
(F480L及びV557L)をSARS-CoVに導入したとき、培養細胞内でレムデ
シビルに対して6倍の感受性低下を示し、SARS-CoV感染マウスモデル
においてウイルスの病原性が減弱した。また、Nsp12にF480L及びV557L
の各変異を導入した組換えSARS-CoV-2では、レムデシビルに対して2
倍の感受性低下を示した11)。
*18.4 動物モデルにおける治療効果
SARS-CoV-2接種12時間後のアカゲザルSARS-CoV-2感染モデルに、
投与初日はレムデシビル10mg/kgで1日1回、その後は5mg/kgで1日1回
を静脈内ボーラス投与したところ、溶媒対照と比較して、呼吸器系疾患
の臨床徴候が改善し、肺病理像及び肺病変所見並びに肺ウイルスRNA量
が減少した。
なお、本試験の主な選択・除外基準は下表のとおりであった。
19. 有効成分に関する理化学的知見
主な選択・除外基準
選択基準
除外基準
一般的名称:レムデシビル(Remdesivir)
化学名:2-EthylbutylN-{(S)-[2-C-(4-aminopyrrolo[2,1-f][1,2,4]
triazin-7-yl)-2,5-anhydro-D-altrononitril-6-O-yl]
phenoxyphosphoryl}-L-alaninate
分子式:C27H35N6O8P
分子量:602.58
化学構造式:
1.無作為化前4日以内に実施したPCR検査においてSARSCoV-2感染が確認されている
2.入院中であり、COVID-19に対する治療を要する
3.スクリーニング時に、SpO2が94%超(室内気)
4.画像上、肺浸潤影が認められる
1.スクリーニング時に人工呼吸器の使用を要する
2.ALT又はASTが基準範囲上限の5倍超
3.クレアチニン・クリアランスが50mL/min未満(18歳以
上の場合はCockcroft-Gault式、18歳未満の場合は
Schwartz式を用いて算出)
4.妊娠検査陽性
5.授乳中
副作用が認められた被験者の割合は、5日間投与群及び10日間投与群でそ
れぞれ19%(36/191例)及び13%(25/193例)であった。主な副作用は、
悪心(5日間投与群で7%(13/191例)、10日間投与群で4%(7/193例))
であった。
注3)7点順序尺度[スコア1:死亡、2:入院かつECMO又は侵襲的人工
呼吸器による管理、3:入院かつ非侵襲的換気又は高流量酸素による
管理、4:入院かつ低流量酸素による管理、5:入院しており、酸素
吸入を要しないがSARS-CoV-2による感染症に関わらず継続的な治
療を要する、6:入院しており、酸素吸入及び継続的な治療は要しな
い(ただし、プロトコルに従った本剤の投与は除く)
、7:退院]
性 状:白色~微黄白色又は黄色の固体
溶解性:メタノール、テトラヒドロフランに溶けやすく、エタノールに
やや溶けやすく、酢酸イソプロピルに溶けにくい。
融 点:138℃
分配係数:logP=3.2
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
-4-