よむ、つかう、まなぶ。
【資料No.1】1.7_同種同効品一覧表 (26 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
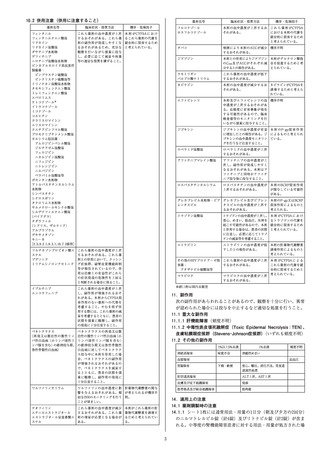
19. 有効成分に関する理化学的知見
一般的名称:ソトロビマブ(遺伝子組換え)
Sotrovimab(Genetical Recombination)
本
質:ソトロビマブは遺伝子組換え抗SARS-CoV-2スパイクタン
パク質モノクローナル抗体であり、ヒトIgG1に由来する。
H鎖の438及び444番目のアミノ酸残基は、それぞれLeu及び
Serに置換されている。ソトロビマブは、チャイニーズハム
スター卵巣細胞により産生される。ソトロビマブは、457個
のアミノ酸残基からなるH鎖(γ1鎖)2本及び214個のアミ
ノ酸残基からなるL鎖(λ鎖)2本で構成される糖タンパク質
(分子量:約149,000)である。
分 子 式:C6492H10060N1744O2038S40(糖鎖部分を含まない)
分 子 量:約149,000
20. 取扱い上の注意
凍結を避けて保存すること。外箱開封後は遮光して保存すること。
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 本剤の投与が適切と判断される症例のみを対象に、あらかじめ患者又
は代諾者に有効性及び安全性に関する情報が文書をもって説明され、文書
による同意を得てから初めて投与されるよう、医師に対して要請すること。
21.3 医薬品医療機器等法施行規則第41条に基づく資料の提出の猶予期間は、
承認取得から起算して4ヶ月とする。また、提出された資料等により、承
認事項を変更する必要が認められた場合には、医薬品医療機器等法第74条
の2第3項に基づき承認事項の変更を命ずることがあること。
21.4 新規変異株の流行が懸念される場合、当該変異株に対する中和活性等
を速やかに検討し、その結果を厚生労働省に提出すること。
21.5 本剤の有効性が減弱するおそれがある変異株が流行している場合は、
新規変異株に対する中和活性、新規変異株の地域ごとの流行状況等を踏ま
え、適切な患者に対して投与するよう医師に対して要請するなど、本剤の
適正な使用が確保されるよう必要な措置を講じること。
22. 包装
8mL[1バイアル]
24. 文献請求先及び問い合わせ先
グラクソ・スミスクライン株式会社
東京都港区赤坂1-8-1
カスタマー・ケア・センター
TEL :0120-561-007(9:00~17:45/土日祝日及び当社休業日を除く)
FAX:0120-561-047(24時間受付)
26. 製造販売業者等
26.1 製造販売元
-3-
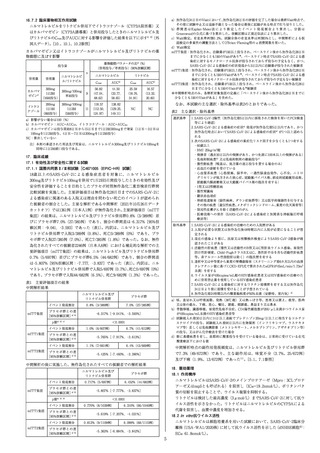
一般的名称:ソトロビマブ(遺伝子組換え)
Sotrovimab(Genetical Recombination)
本
質:ソトロビマブは遺伝子組換え抗SARS-CoV-2スパイクタン
パク質モノクローナル抗体であり、ヒトIgG1に由来する。
H鎖の438及び444番目のアミノ酸残基は、それぞれLeu及び
Serに置換されている。ソトロビマブは、チャイニーズハム
スター卵巣細胞により産生される。ソトロビマブは、457個
のアミノ酸残基からなるH鎖(γ1鎖)2本及び214個のアミ
ノ酸残基からなるL鎖(λ鎖)2本で構成される糖タンパク質
(分子量:約149,000)である。
分 子 式:C6492H10060N1744O2038S40(糖鎖部分を含まない)
分 子 量:約149,000
20. 取扱い上の注意
凍結を避けて保存すること。外箱開封後は遮光して保存すること。
21. 承認条件
21.1 医薬品リスク管理計画を策定の上、適切に実施すること。
21.2 本剤の投与が適切と判断される症例のみを対象に、あらかじめ患者又
は代諾者に有効性及び安全性に関する情報が文書をもって説明され、文書
による同意を得てから初めて投与されるよう、医師に対して要請すること。
21.3 医薬品医療機器等法施行規則第41条に基づく資料の提出の猶予期間は、
承認取得から起算して4ヶ月とする。また、提出された資料等により、承
認事項を変更する必要が認められた場合には、医薬品医療機器等法第74条
の2第3項に基づき承認事項の変更を命ずることがあること。
21.4 新規変異株の流行が懸念される場合、当該変異株に対する中和活性等
を速やかに検討し、その結果を厚生労働省に提出すること。
21.5 本剤の有効性が減弱するおそれがある変異株が流行している場合は、
新規変異株に対する中和活性、新規変異株の地域ごとの流行状況等を踏ま
え、適切な患者に対して投与するよう医師に対して要請するなど、本剤の
適正な使用が確保されるよう必要な措置を講じること。
22. 包装
8mL[1バイアル]
24. 文献請求先及び問い合わせ先
グラクソ・スミスクライン株式会社
東京都港区赤坂1-8-1
カスタマー・ケア・センター
TEL :0120-561-007(9:00~17:45/土日祝日及び当社休業日を除く)
FAX:0120-561-047(24時間受付)
26. 製造販売業者等
26.1 製造販売元
-3-