よむ、つかう、まなぶ。
【資料No.1】1.7_同種同効品一覧表 (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
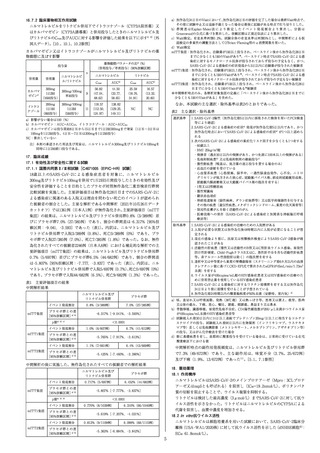
ビマブ600mg併用投与群は注射部位反応4.0%(53/1311
例)
、プラセボ群は注射部位反応1.3%(17/1306例)であっ
陽性となった検体採取日から14日以内である被験者(イ
ベント)の割合を評価した。
コホートA(ベースラインのRT-qPCRが陰性)において、
イベント発現例数はカシリビマブ600mg及びイムデビマブ
600mg併用投与群では11/753例(1.5%)、プラセボ群では
59/752例(7.8%)であり、リスク減少率は81.4%(95%信
頼区間:65.3%、90.1%)、オッズ比は0.17(95%信頼区間:
た。コホートBにおける副作用の発現状況は、カシリビマ
ブ600mg及びイムデビマブ600mg併用投与群4.5%(7/155
例)、プラセボ群4.5%(7/156例)であった6)。発現割合が
1%以上の副作用は、カシリビマブ600mg及びイムデビマ
ブ600mg併用投与群は注射部位反応3.9%(6/155例)、プ
ラセボ群はCOVID-19が1.3%(2/156例)であった。
[5.3、
0.090、0.332)(ロジスティック回帰分析、P<0.0001)で
あった5)。コホートB(ベースラインのRT-qPCRが陽性)
7.4参照]
において、イベント発現例数はカシリビマブ600mg及びイ
ムデビマブ600mg併用投与群では29/100例(29.0%)、プ
ラセボ群では44/104例(42.3%)であり、リスク減少率は
注1)mFAS:ベースライン時の鼻咽頭ぬぐい検体を用い
たSARS-CoV-2のRT-qPCR検査結果が陽性であっ
た患者集団
31.5%(95%信頼区間:0.3%、53.4%)、オッズ比は0.54
(95%信頼区間:0.298、0.966)
(ロジスティック回帰分析、
P=0.0380)であった5)。
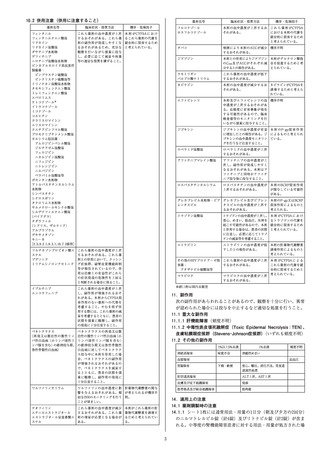
表17-4 家庭内で最初のSARS-CoV-2感染者と同居する
注2)
(1-カシリビマブ600mg及びイムデビマブ600mg併
用投与群のイベント発現割合/プラセボ群のイベン
ト発現割合)×100
注3)治験責任医師等により、SARS-CoV-2による感染症
に関連する事象であるか否かが判断された。
SARS-CoV-2による感染症の症状がない被験者に対する
有効性
カシリビマブ600mg
及びイムデビマブ
600mg併用投与群
コホートA
イベント発現割合
リスク減少率注2)
オッズ比注4)
コホートB
イベント発現割合
リスク減少率注2)
オッズ比注4)
注4)治療群、地域(米国、米国以外)、年齢(12歳以上
50歳未満、50歳以上)を固定効果としたロジスティッ
ク回帰
プラセボ群
18. 薬効薬理
1.5%
7.8%
(11/753例)
(59/752例)
81.4%
(95%信頼区間:65.3%、90.1%)
0.17
(95%信頼区間:0.090、0.332)
(P<0.0001)
29.0%
42.3%
(29/100例)
(44/104例)
31.5%
(95%信頼区間:0.3%、53.4%)
0.54
(95%信頼区間:0.298、0.966)
(P=0.0380)
なお、本試験の主な選択・除外基準は表17-5の通りであっ
た。
表17-5 主な選択・除外基準
選択 1.家庭内で最初のSARS-CoV-2感染者(初発例)と同
基準 居する無症候の被験者。なお、初発例においてSARS-
18.1 作用機序
カシリビマブ及びイムデビマブは、SARS-CoV-2ウイル
スのスパイクタンパク質を認識し、SARS-CoV-2の宿主
細胞への侵入を阻害することにより、ウイルスの増殖を
抑制すると考えられている7)。また、カシリビマブ及びイ
ムデビマブはSARS-CoV-2のスパイクタンパク質に対し
て異なる部位を認識する8),9)。
**
18.2
変異株に対する効果
*
In vitro における検討において、懸念すべき変異株(VOC)
及び注目すべき変異株(VOI)のうち、alpha株(B.1.1.7
系統)、beta株(B.1.351系統)、gamma株(P.1系統)、
delta株(B.1.617.2及びAY.3系統)、epsilon株(B.1.427
及び B.1.429系統)、B.1.526.1系統、zeta株(P.2系統)
、
eta株(B.1.525系統)、theta株(P.3系統)、iota株(B.1.526
系統)、R.1系統、kappa株(B.1.617.1系統)、B.1.617.3
系統及びmu株(B.1.621及びB.1.621.1系統)のスパイ
クタンパク質の全配列又はその主要変異に対して本剤が
中和活性を保持していることが示唆された10),11)。一方で
omicron株(B.1.1.529系統)のスパイクタンパク質の全
配列に対しては本剤の中和活性は著しく減弱することが
示唆された10)。[5.4参照]
CoV-2陽性が確認された検体の採取から96時間以内に
被験者が無作為化される必要がある
2.無作為化後29日目まで初発例と生活を共にすること
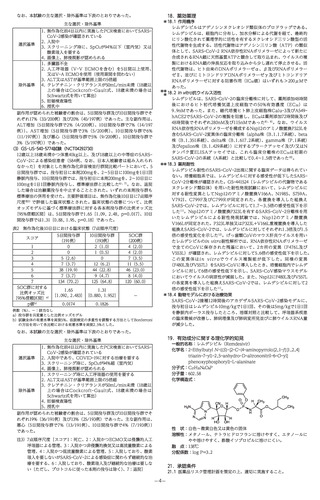
19. 有効成分に関する理化学的知見
が見込まれる
3.既往歴及びスクリーニング時の診察に基づき治験責
任医師等により健康であると判断される(慢性かつ安
一般的名称:カシリビマブ(遺伝子組換え)
(Casirivimab(Genetical Recombination))
(JAN)
分子式:C6454H9976N1704O2024S44
分子量:約148,000
構造式:アミノ酸残基214個のL鎖2本とアミノ酸残基450個
のH鎖2本からなる糖タンパク質
定した症状を有する場合を含む)
除外 1.被験者の申告に基づき、SARS-CoV-2のRT-PCR陽
基準 性又は血清学的検査陽性であったことがある
2.初発例を除き、SARS-CoV-2感染の既往歴を有する
者と同居したことがある又はSARS-CoV-2感染者と同
居している
一般的名称:イムデビマブ(遺伝子組換え)
(Imdevimab(Genetical Recombination))
(JAN)
3.SARS-CoV-2による感染症に合致する症状(呼吸器
症状に限らない)を有する
4.スクリーニング前6カ月以内にSARS-CoV-2による
分子式:C6396H9882N1694O2018S42
感染症の症状を伴う呼吸器疾患の既往歴を有する
5.ナーシングホームに入居している
6.SARS-CoV-2による感染症に対するワクチン(承認
分子量:約147,000
構造式:アミノ酸残基216個のL鎖2本とアミノ酸残基450個
のH鎖2本からなる糖タンパク質
の有無を問わない)の接種歴がある
20. 取扱い上の注意
コホートAにおける副作用の発現状況は、カシリビマブ
600mg及びイムデビマブ600mg併用投与群4.3%(57/1311
外箱開封後は遮光して保存すること。
6)
例)、プラセボ群2.5%(32/1306例)であった 。発現割
合が1%以上の副作用は、カシリビマブ600mg及びイムデ
(4)
例)
、プラセボ群は注射部位反応1.3%(17/1306例)であっ
陽性となった検体採取日から14日以内である被験者(イ
ベント)の割合を評価した。
コホートA(ベースラインのRT-qPCRが陰性)において、
イベント発現例数はカシリビマブ600mg及びイムデビマブ
600mg併用投与群では11/753例(1.5%)、プラセボ群では
59/752例(7.8%)であり、リスク減少率は81.4%(95%信
頼区間:65.3%、90.1%)、オッズ比は0.17(95%信頼区間:
た。コホートBにおける副作用の発現状況は、カシリビマ
ブ600mg及びイムデビマブ600mg併用投与群4.5%(7/155
例)、プラセボ群4.5%(7/156例)であった6)。発現割合が
1%以上の副作用は、カシリビマブ600mg及びイムデビマ
ブ600mg併用投与群は注射部位反応3.9%(6/155例)、プ
ラセボ群はCOVID-19が1.3%(2/156例)であった。
[5.3、
0.090、0.332)(ロジスティック回帰分析、P<0.0001)で
あった5)。コホートB(ベースラインのRT-qPCRが陽性)
7.4参照]
において、イベント発現例数はカシリビマブ600mg及びイ
ムデビマブ600mg併用投与群では29/100例(29.0%)、プ
ラセボ群では44/104例(42.3%)であり、リスク減少率は
注1)mFAS:ベースライン時の鼻咽頭ぬぐい検体を用い
たSARS-CoV-2のRT-qPCR検査結果が陽性であっ
た患者集団
31.5%(95%信頼区間:0.3%、53.4%)、オッズ比は0.54
(95%信頼区間:0.298、0.966)
(ロジスティック回帰分析、
P=0.0380)であった5)。
表17-4 家庭内で最初のSARS-CoV-2感染者と同居する
注2)
(1-カシリビマブ600mg及びイムデビマブ600mg併
用投与群のイベント発現割合/プラセボ群のイベン
ト発現割合)×100
注3)治験責任医師等により、SARS-CoV-2による感染症
に関連する事象であるか否かが判断された。
SARS-CoV-2による感染症の症状がない被験者に対する
有効性
カシリビマブ600mg
及びイムデビマブ
600mg併用投与群
コホートA
イベント発現割合
リスク減少率注2)
オッズ比注4)
コホートB
イベント発現割合
リスク減少率注2)
オッズ比注4)
注4)治療群、地域(米国、米国以外)、年齢(12歳以上
50歳未満、50歳以上)を固定効果としたロジスティッ
ク回帰
プラセボ群
18. 薬効薬理
1.5%
7.8%
(11/753例)
(59/752例)
81.4%
(95%信頼区間:65.3%、90.1%)
0.17
(95%信頼区間:0.090、0.332)
(P<0.0001)
29.0%
42.3%
(29/100例)
(44/104例)
31.5%
(95%信頼区間:0.3%、53.4%)
0.54
(95%信頼区間:0.298、0.966)
(P=0.0380)
なお、本試験の主な選択・除外基準は表17-5の通りであっ
た。
表17-5 主な選択・除外基準
選択 1.家庭内で最初のSARS-CoV-2感染者(初発例)と同
基準 居する無症候の被験者。なお、初発例においてSARS-
18.1 作用機序
カシリビマブ及びイムデビマブは、SARS-CoV-2ウイル
スのスパイクタンパク質を認識し、SARS-CoV-2の宿主
細胞への侵入を阻害することにより、ウイルスの増殖を
抑制すると考えられている7)。また、カシリビマブ及びイ
ムデビマブはSARS-CoV-2のスパイクタンパク質に対し
て異なる部位を認識する8),9)。
**
18.2
変異株に対する効果
*
In vitro における検討において、懸念すべき変異株(VOC)
及び注目すべき変異株(VOI)のうち、alpha株(B.1.1.7
系統)、beta株(B.1.351系統)、gamma株(P.1系統)、
delta株(B.1.617.2及びAY.3系統)、epsilon株(B.1.427
及び B.1.429系統)、B.1.526.1系統、zeta株(P.2系統)
、
eta株(B.1.525系統)、theta株(P.3系統)、iota株(B.1.526
系統)、R.1系統、kappa株(B.1.617.1系統)、B.1.617.3
系統及びmu株(B.1.621及びB.1.621.1系統)のスパイ
クタンパク質の全配列又はその主要変異に対して本剤が
中和活性を保持していることが示唆された10),11)。一方で
omicron株(B.1.1.529系統)のスパイクタンパク質の全
配列に対しては本剤の中和活性は著しく減弱することが
示唆された10)。[5.4参照]
CoV-2陽性が確認された検体の採取から96時間以内に
被験者が無作為化される必要がある
2.無作為化後29日目まで初発例と生活を共にすること
19. 有効成分に関する理化学的知見
が見込まれる
3.既往歴及びスクリーニング時の診察に基づき治験責
任医師等により健康であると判断される(慢性かつ安
一般的名称:カシリビマブ(遺伝子組換え)
(Casirivimab(Genetical Recombination))
(JAN)
分子式:C6454H9976N1704O2024S44
分子量:約148,000
構造式:アミノ酸残基214個のL鎖2本とアミノ酸残基450個
のH鎖2本からなる糖タンパク質
定した症状を有する場合を含む)
除外 1.被験者の申告に基づき、SARS-CoV-2のRT-PCR陽
基準 性又は血清学的検査陽性であったことがある
2.初発例を除き、SARS-CoV-2感染の既往歴を有する
者と同居したことがある又はSARS-CoV-2感染者と同
居している
一般的名称:イムデビマブ(遺伝子組換え)
(Imdevimab(Genetical Recombination))
(JAN)
3.SARS-CoV-2による感染症に合致する症状(呼吸器
症状に限らない)を有する
4.スクリーニング前6カ月以内にSARS-CoV-2による
分子式:C6396H9882N1694O2018S42
感染症の症状を伴う呼吸器疾患の既往歴を有する
5.ナーシングホームに入居している
6.SARS-CoV-2による感染症に対するワクチン(承認
分子量:約147,000
構造式:アミノ酸残基216個のL鎖2本とアミノ酸残基450個
のH鎖2本からなる糖タンパク質
の有無を問わない)の接種歴がある
20. 取扱い上の注意
コホートAにおける副作用の発現状況は、カシリビマブ
600mg及びイムデビマブ600mg併用投与群4.3%(57/1311
外箱開封後は遮光して保存すること。
6)
例)、プラセボ群2.5%(32/1306例)であった 。発現割
合が1%以上の副作用は、カシリビマブ600mg及びイムデ
(4)