よむ、つかう、まなぶ。
【資料No.1】1.7_同種同効品一覧表 (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26901.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第3回 7/20)、医薬品第二部会(令和4年度第6回 7/20)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
(2)外国人のSARS-CoV-2による感染症患者
COV-2067試験における18歳以上のSARS-CoV-2による感染症患者
を対象にカシリビマブ及びイムデビマブそれぞれ600~4000mg注1)
を60分かけて単回点滴静注した際の薬物動態パラメータは以下の通
(外国人データ)
。
りであった1)
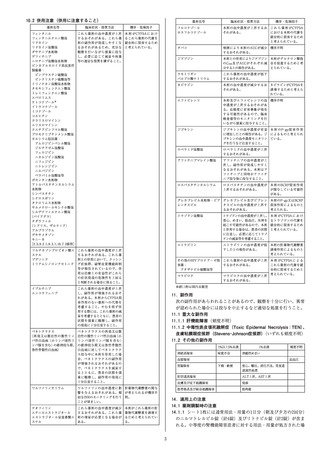
表16-3 外国人のSARS-CoV-2による感染症患者における単回点滴
静注時のカシリビマブ及びイムデビマブの薬物動態パラメータ
用量(mg)
カシリビマブ
600
1200
4000
イムデビマブ
600
1200
4000
Cmax注2)
(mg/L)
192±80.9
[183]
331±109
[807]
1077±323
[631]
198±84.8
[196]
331±114
[846]
1073±309
[647]
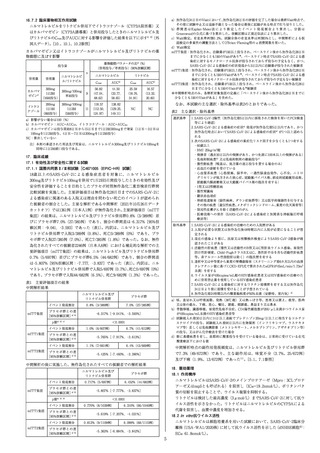
表17-2 主な選択・除外基準
選択 1.SARS-CoV-2陽性(無作為化前72時間以内に採取された鼻
基準 咽頭、鼻腔、口腔咽頭又は唾液検体を用いた抗原検査又はRTPCR検査等により確認)
2.SARS-CoV-2による感染症に合致する症状を有すると治験責
任医師等が判断し、かつ、当該症状発症が無作為化前7日以内
3.酸素飽和度が93%以上(室内気)
4.次のSARS-CoV-2による感染症の重症化リスク因子を少な
C28注3)
(mg/L)
46.2±22.3
[144]
78.0±28.6
[926]
255±88.2
[791]
38.5±19.7
[144]
63.8±23.9
[926]
207±74.0
[774]
くとも一つ有する
・50歳以上
・肥満(BMI 30kg/m2以上)
・心血管疾患(高血圧を含む)
・慢性肺疾患(喘息を含む)
・1型又は2型糖尿病
・慢性腎障害(透析患者を含む)
・慢性肝疾患
・免疫抑制状態(治験責任医師等の判断による。例:悪性腫
瘍治療、骨髄又は臓器移植、免疫不全、コントロール不良の
HIV、AIDS、鎌状赤血球貧血、サラセミア、免疫抑制剤の長
期投与)
除外 1.無作為化の前にSARS-CoV-2による感染症により入院した患
平均値±標準偏差[例数]
基準 者又は無作為化時点で入院中(理由を問わず)の患者
2.血清学的検査によりSARS-CoV-2抗体陽性であることが判
明している患者
注1)点滴静注及び皮下注射いずれにおいても、カシリビマブ及び
イムデビマブの承認用量はそれぞれ600mgである。
注2)点滴静注直後の血清中濃度
注3)投与28日後の血清中濃度
注4)皮下注射後の最高血清中濃度
3.無作為化前の72時間より前に採取された検体を用いた抗原
検査又はRT-PCR検査等によりSARS-CoV-2陽性である患者
4.SARS-CoV-2による感染症に対するワクチン(承認の有無
を問わない)を無作為化前若しくは無作為化時に接種した、
又は治験薬投与後90日以内(米国CDCの推奨期間があれば従
う)に接種予定の患者
17. 臨床成績
17.1 有効性及び安全性に関する試験
〈SARS-CoV-2による感染症〉
*17.1.1 海外第Ⅰ/Ⅱ/Ⅲ相試験(COV-2067試験)
18歳以上のSARS-CoV-2による感染症患者を対象に、本剤単回
点滴静注時の有効性、安全性及び忍容性を評価することを目的と
して、第Ⅰ/Ⅱ/Ⅲ相、プラセボ対照無作為化二重盲検並行群間比
較試験を実施した。第Ⅲ相パートでは、重症化リスク因子を有し
酸素飽和度93%(室内気)以上のSARS-CoV-2による感染症患者
を対象に、主要評価項目である無作為化後29日目までのSARSCoV-2による感染症に関連のある入院又は理由を問わない死亡(イ
ベント)が認められた被験者の割合を評価した。イベント発現例
数は、カシリビマブ600mg及びイムデビマブ600mg併用投与群で
は7/736例(1.0%)、プラセボ群では24/748例(3.2%)であり、リ
本試験(第Ⅲ相パート)では、重篤な有害事象、投与後3日目まで
に発現したグレード2以上のinfusion reaction、投与後28日目まで
に発現したグレード2以上の過敏症反応、投与後28日目までに発現
した有害事象で医療機関受診に至った有害事象のみが収集された。
有害事象の発現状況は表17-3の通りであった4)。本剤群で報告され
た副作用は、infusion reaction 2例(0.2%)であった。
[5.1、7.1参照]
なお、グレード分類はCommon Terminology Criteria for Adverse
Events(CTCAE)等が用いられた。
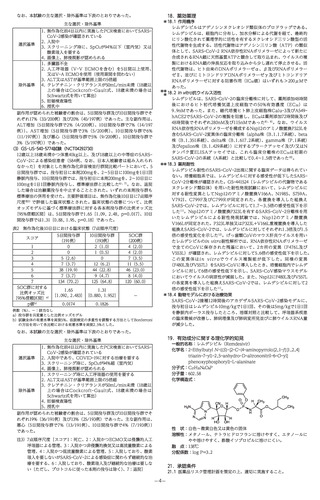
表17-3 有害事象の発現状況
安全性解析集団例数
重篤な有害事象
スク減少率は70.4%(95%信頼区間:31.6%、87.1%)(CochranMantel-Haenszel検定、p=0.0024)であった3)。
表17-1 SARS-CoV-2による感染症に対する有効性
mFAS注1)集団例数
無作為化後29日目まで
のSARS-CoV-2 による
感染症に関連のある入
院又は理由を問わない
死亡のリスク減少率注2)
イベント発現例数
infusion reaction
カシリビマブ600mg及びイム
プラセボ群
デビマブ600mg併用投与群
736例
748例
70.4%
(95%信頼区間:31.6%、87.1%)
(p=0.0024)
7例
(1.0%)
24例
(3.2%)
過敏症反応
カシリビマブ600mg及びイム
プラセボ群
デビマブ600mg併用投与群
827例
1843例
9例
74例
(1.1%)
2例
(0.2%)
0
(4.0%)
0
1例
(0.1%未満)
医療機関受診に至った
有害事象
(SARS-CoV-2による感
染症に関連しない)注3)
医療機関受診に至った
有害事象
(SARS-CoV-2による
感染症に関連する)注3)
なお、本試験の主な選択・除外基準は表17-2の通りであった。
0
15例
(1.8%)
5例
(0.3%)
47例
(2.6%)
〈SARS-CoV-2による感染症の発症抑制〉
*17.1.2 海外第Ⅲ相試験(COV-2069試験)
家庭内で最初のSARS-CoV-2感染者と同居するSARS-CoV-2によ
る感染症の症状がない12歳以上の被験者を対象に、本剤単回皮下
注射時の有効性及び安全性を評価することを目的として、第Ⅲ相、
プラセボ対照無作為化二重盲検並行群間比較試験を実施した。本
試験では、主要評価項目である無作為化後29日目までにSARSCoV-2による感染症の症状が認められ、かつ症状発現がRT-qPCR
(3)
COV-2067試験における18歳以上のSARS-CoV-2による感染症患者
を対象にカシリビマブ及びイムデビマブそれぞれ600~4000mg注1)
を60分かけて単回点滴静注した際の薬物動態パラメータは以下の通
(外国人データ)
。
りであった1)
表16-3 外国人のSARS-CoV-2による感染症患者における単回点滴
静注時のカシリビマブ及びイムデビマブの薬物動態パラメータ
用量(mg)
カシリビマブ
600
1200
4000
イムデビマブ
600
1200
4000
Cmax注2)
(mg/L)
192±80.9
[183]
331±109
[807]
1077±323
[631]
198±84.8
[196]
331±114
[846]
1073±309
[647]
表17-2 主な選択・除外基準
選択 1.SARS-CoV-2陽性(無作為化前72時間以内に採取された鼻
基準 咽頭、鼻腔、口腔咽頭又は唾液検体を用いた抗原検査又はRTPCR検査等により確認)
2.SARS-CoV-2による感染症に合致する症状を有すると治験責
任医師等が判断し、かつ、当該症状発症が無作為化前7日以内
3.酸素飽和度が93%以上(室内気)
4.次のSARS-CoV-2による感染症の重症化リスク因子を少な
C28注3)
(mg/L)
46.2±22.3
[144]
78.0±28.6
[926]
255±88.2
[791]
38.5±19.7
[144]
63.8±23.9
[926]
207±74.0
[774]
くとも一つ有する
・50歳以上
・肥満(BMI 30kg/m2以上)
・心血管疾患(高血圧を含む)
・慢性肺疾患(喘息を含む)
・1型又は2型糖尿病
・慢性腎障害(透析患者を含む)
・慢性肝疾患
・免疫抑制状態(治験責任医師等の判断による。例:悪性腫
瘍治療、骨髄又は臓器移植、免疫不全、コントロール不良の
HIV、AIDS、鎌状赤血球貧血、サラセミア、免疫抑制剤の長
期投与)
除外 1.無作為化の前にSARS-CoV-2による感染症により入院した患
平均値±標準偏差[例数]
基準 者又は無作為化時点で入院中(理由を問わず)の患者
2.血清学的検査によりSARS-CoV-2抗体陽性であることが判
明している患者
注1)点滴静注及び皮下注射いずれにおいても、カシリビマブ及び
イムデビマブの承認用量はそれぞれ600mgである。
注2)点滴静注直後の血清中濃度
注3)投与28日後の血清中濃度
注4)皮下注射後の最高血清中濃度
3.無作為化前の72時間より前に採取された検体を用いた抗原
検査又はRT-PCR検査等によりSARS-CoV-2陽性である患者
4.SARS-CoV-2による感染症に対するワクチン(承認の有無
を問わない)を無作為化前若しくは無作為化時に接種した、
又は治験薬投与後90日以内(米国CDCの推奨期間があれば従
う)に接種予定の患者
17. 臨床成績
17.1 有効性及び安全性に関する試験
〈SARS-CoV-2による感染症〉
*17.1.1 海外第Ⅰ/Ⅱ/Ⅲ相試験(COV-2067試験)
18歳以上のSARS-CoV-2による感染症患者を対象に、本剤単回
点滴静注時の有効性、安全性及び忍容性を評価することを目的と
して、第Ⅰ/Ⅱ/Ⅲ相、プラセボ対照無作為化二重盲検並行群間比
較試験を実施した。第Ⅲ相パートでは、重症化リスク因子を有し
酸素飽和度93%(室内気)以上のSARS-CoV-2による感染症患者
を対象に、主要評価項目である無作為化後29日目までのSARSCoV-2による感染症に関連のある入院又は理由を問わない死亡(イ
ベント)が認められた被験者の割合を評価した。イベント発現例
数は、カシリビマブ600mg及びイムデビマブ600mg併用投与群で
は7/736例(1.0%)、プラセボ群では24/748例(3.2%)であり、リ
本試験(第Ⅲ相パート)では、重篤な有害事象、投与後3日目まで
に発現したグレード2以上のinfusion reaction、投与後28日目まで
に発現したグレード2以上の過敏症反応、投与後28日目までに発現
した有害事象で医療機関受診に至った有害事象のみが収集された。
有害事象の発現状況は表17-3の通りであった4)。本剤群で報告され
た副作用は、infusion reaction 2例(0.2%)であった。
[5.1、7.1参照]
なお、グレード分類はCommon Terminology Criteria for Adverse
Events(CTCAE)等が用いられた。
表17-3 有害事象の発現状況
安全性解析集団例数
重篤な有害事象
スク減少率は70.4%(95%信頼区間:31.6%、87.1%)(CochranMantel-Haenszel検定、p=0.0024)であった3)。
表17-1 SARS-CoV-2による感染症に対する有効性
mFAS注1)集団例数
無作為化後29日目まで
のSARS-CoV-2 による
感染症に関連のある入
院又は理由を問わない
死亡のリスク減少率注2)
イベント発現例数
infusion reaction
カシリビマブ600mg及びイム
プラセボ群
デビマブ600mg併用投与群
736例
748例
70.4%
(95%信頼区間:31.6%、87.1%)
(p=0.0024)
7例
(1.0%)
24例
(3.2%)
過敏症反応
カシリビマブ600mg及びイム
プラセボ群
デビマブ600mg併用投与群
827例
1843例
9例
74例
(1.1%)
2例
(0.2%)
0
(4.0%)
0
1例
(0.1%未満)
医療機関受診に至った
有害事象
(SARS-CoV-2による感
染症に関連しない)注3)
医療機関受診に至った
有害事象
(SARS-CoV-2による
感染症に関連する)注3)
なお、本試験の主な選択・除外基準は表17-2の通りであった。
0
15例
(1.8%)
5例
(0.3%)
47例
(2.6%)
〈SARS-CoV-2による感染症の発症抑制〉
*17.1.2 海外第Ⅲ相試験(COV-2069試験)
家庭内で最初のSARS-CoV-2感染者と同居するSARS-CoV-2によ
る感染症の症状がない12歳以上の被験者を対象に、本剤単回皮下
注射時の有効性及び安全性を評価することを目的として、第Ⅲ相、
プラセボ対照無作為化二重盲検並行群間比較試験を実施した。本
試験では、主要評価項目である無作為化後29日目までにSARSCoV-2による感染症の症状が認められ、かつ症状発現がRT-qPCR
(3)