よむ、つかう、まなぶ。
資料1-2 クロトリマゾールのリスク区分について (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26332.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和4年度第1回 6/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別紙(1)
調査結果の概要
本剤の調査結果(調査期間:平成 30 年 7 月 10 日~令和 3 年 7 月 9 日)を以下の通り示す。
(1)副作用頻度調査
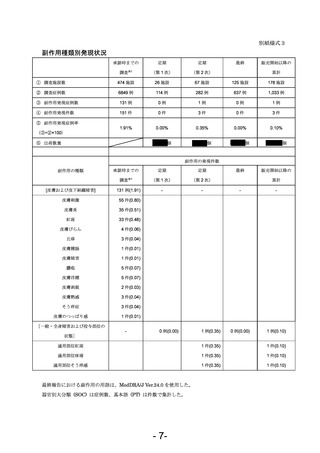
・当該調査期間にモニター施設 178 施設から報告された 1,033 症例において、副作用発現症例数
は 1 例(副作用発現症例率 0.10%)で、副作用発現件数は 3 件であった。
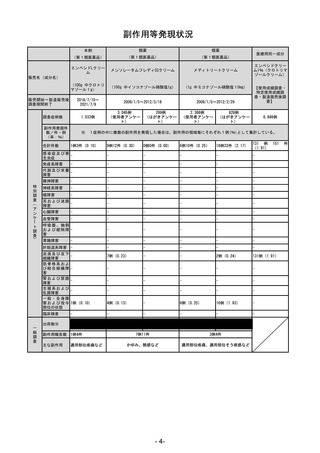
副作用の種類別発現状況は別紙様式3に示すとおりである。
重篤な副作用は報告されず、報告された非重篤な副作用はいずれも既知の副作用であり、
「適用
部位紅斑」
(1 件)
、「適用部位疼痛」
(1 件)
、「適用部位そう痒感」
(1 件)であった。
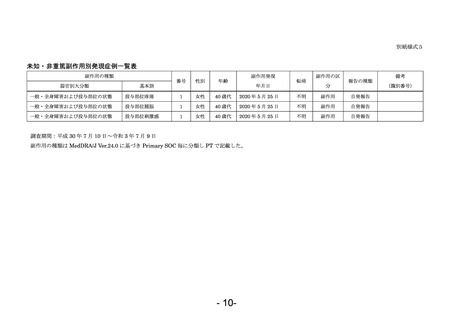
なお、副作用頻度調査における副作用発現症例一覧は、別紙様式4に示すとおりである。
(2)一般調査
・一般調査における副作用発現症例数は 1 例で、副作用発現件数は 4 件であった。当該調査期間
中に独立行政法人医薬品医療機器総合機構(以下、
「PMDA」)に報告を行った重篤な副作用はな
かった(別紙様式6)
。非重篤副作用は 1 例 4 件収集し、未知の副作用が 3 件(「投与部位疼痛」
(1 件)
、「投与部位腫脹」(1 件)
、「投与部位刺激感」
(1 件))
、既知の副作用が 1 件(「適用部位
疼痛)」
(1 件)
)であった。
なお、一般調査における未知・非重篤副作用別発現症例一覧表は、別紙様式5に示すとおりであ
る。
(3)研究報告および外国での規制措置情報
・本剤の承認日以降、当該調査期間終了日(令和 3 年 7 月 9 日)までに研究報告、外国措置報告
の対象となるものはなかった。
- 6-
調査結果の概要
本剤の調査結果(調査期間:平成 30 年 7 月 10 日~令和 3 年 7 月 9 日)を以下の通り示す。
(1)副作用頻度調査
・当該調査期間にモニター施設 178 施設から報告された 1,033 症例において、副作用発現症例数
は 1 例(副作用発現症例率 0.10%)で、副作用発現件数は 3 件であった。
副作用の種類別発現状況は別紙様式3に示すとおりである。
重篤な副作用は報告されず、報告された非重篤な副作用はいずれも既知の副作用であり、
「適用
部位紅斑」
(1 件)
、「適用部位疼痛」
(1 件)
、「適用部位そう痒感」
(1 件)であった。
なお、副作用頻度調査における副作用発現症例一覧は、別紙様式4に示すとおりである。
(2)一般調査
・一般調査における副作用発現症例数は 1 例で、副作用発現件数は 4 件であった。当該調査期間
中に独立行政法人医薬品医療機器総合機構(以下、
「PMDA」)に報告を行った重篤な副作用はな
かった(別紙様式6)
。非重篤副作用は 1 例 4 件収集し、未知の副作用が 3 件(「投与部位疼痛」
(1 件)
、「投与部位腫脹」(1 件)
、「投与部位刺激感」
(1 件))
、既知の副作用が 1 件(「適用部位
疼痛)」
(1 件)
)であった。
なお、一般調査における未知・非重篤副作用別発現症例一覧表は、別紙様式5に示すとおりであ
る。
(3)研究報告および外国での規制措置情報
・本剤の承認日以降、当該調査期間終了日(令和 3 年 7 月 9 日)までに研究報告、外国措置報告
の対象となるものはなかった。
- 6-