よむ、つかう、まなぶ。
総-9参考1 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_68608.html |
| 出典情報 | 中央社会保険医療協議会 総会(第641回 1/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1) 申請に係る再生医療等製品が均質でないこと
(医薬品医療機器等法第 23 条
の 26 第1項第1号)の考え方
例1:ヒトから採取した細胞は、均一な細胞集団ではなく、培養や分化等
の加工によってもさらに形質が変化し、亜集団が生じるため、細胞加工製
品は均質ではないと考えられる場合もある。
例2:体内で発現する遺伝子を含有しているものについては、その発現過
程で薬理作用発現物質の発現量が均質ではないと考えられる場合もある。
なお、上記に挙げたものは、例示であり、不均質の考え方を示したもの
である。
2) 申請に係る効能、効果又は性能を有すると推定されるものであること(医
薬品医療機器等法第 23 条の 26 第1項第2号)の考え方
適切な臨床試験データから有効性について評価することが可能であり、
申請に係る効能、効果又は性能を有すると推定されるもの。
本制度の適用を前提とした開発を行う場合は、申請前に独立行政法人医
薬品医療機器総合機構の対面助言を利用し治験デザインの適切性を相談
することが勧められる。有効性の推定であっても、評価の対象となる臨床
試験は、適切なデザイン及び運用により実施されることが前提であり、例
えば、臨床的に意義のある適切な評価項目が設定されていること、評価者
等のバイアスを最小化するための適切な方策がとられていること、臨床試
験の信頼性を確保するための適切な運用がなされていることが必要とな
る。有効性評価指標については、基本的には確立した指標で評価する必要
があるが、評価指標が確立していない場合は、臨床的意義の期待できる評
価項目であることを説明する必要がある。事前に定められた仮説により全
体集団で有効性の傾向を確認する試験を計画できれば、規制当局との合意
が得られやすい。そのために、有効性が推定できたことを判断するための
達成基準を統計学的に設定できるかが重要となる。必要となる被験者数の
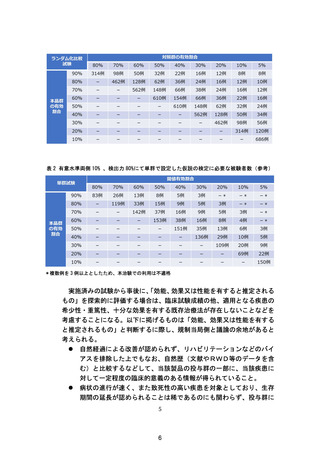
一般的な算出方法の例として、表 1 及び表 2 を参考にされたい。なお、評
価指標に基づく、仮説の新たな提案は、製品の特徴、疾患等の要素に応じ
てケースバイケースで議論する必要があることから、対面助言を通じて合
意しておくことが望ましい。
表 1 有意水準両側 10% 、検出力 80%、1:1 割付で 2 群にて設定した仮説の検定に
必要な被験者数(参考)
4
5
(医薬品医療機器等法第 23 条
の 26 第1項第1号)の考え方
例1:ヒトから採取した細胞は、均一な細胞集団ではなく、培養や分化等
の加工によってもさらに形質が変化し、亜集団が生じるため、細胞加工製
品は均質ではないと考えられる場合もある。
例2:体内で発現する遺伝子を含有しているものについては、その発現過
程で薬理作用発現物質の発現量が均質ではないと考えられる場合もある。
なお、上記に挙げたものは、例示であり、不均質の考え方を示したもの
である。
2) 申請に係る効能、効果又は性能を有すると推定されるものであること(医
薬品医療機器等法第 23 条の 26 第1項第2号)の考え方
適切な臨床試験データから有効性について評価することが可能であり、
申請に係る効能、効果又は性能を有すると推定されるもの。
本制度の適用を前提とした開発を行う場合は、申請前に独立行政法人医
薬品医療機器総合機構の対面助言を利用し治験デザインの適切性を相談
することが勧められる。有効性の推定であっても、評価の対象となる臨床
試験は、適切なデザイン及び運用により実施されることが前提であり、例
えば、臨床的に意義のある適切な評価項目が設定されていること、評価者
等のバイアスを最小化するための適切な方策がとられていること、臨床試
験の信頼性を確保するための適切な運用がなされていることが必要とな
る。有効性評価指標については、基本的には確立した指標で評価する必要
があるが、評価指標が確立していない場合は、臨床的意義の期待できる評
価項目であることを説明する必要がある。事前に定められた仮説により全
体集団で有効性の傾向を確認する試験を計画できれば、規制当局との合意
が得られやすい。そのために、有効性が推定できたことを判断するための
達成基準を統計学的に設定できるかが重要となる。必要となる被験者数の
一般的な算出方法の例として、表 1 及び表 2 を参考にされたい。なお、評
価指標に基づく、仮説の新たな提案は、製品の特徴、疾患等の要素に応じ
てケースバイケースで議論する必要があることから、対面助言を通じて合
意しておくことが望ましい。
表 1 有意水準両側 10% 、検出力 80%、1:1 割付で 2 群にて設定した仮説の検定に
必要な被験者数(参考)
4
5