よむ、つかう、まなぶ。
総-9参考1 (4 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_68608.html |
| 出典情報 | 中央社会保険医療協議会 総会(第641回 1/14)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
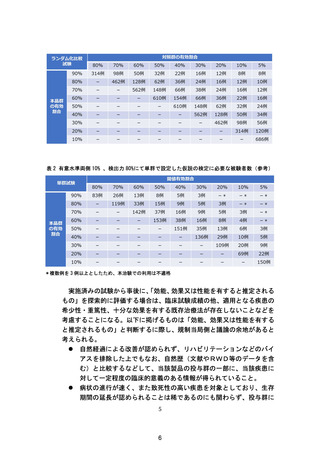
されるものであり、申請内容等に対して拘束力を有するものではない。また、再
生医療等製品の条件及び期限付承認の判断やその後の有効性評価計画の評価に
あたっては、申請者は個別の製品に固有の特性も十分理解した上で、
「合理性の
ある判断又は評価が達成できない可能性」を最小化することを目指しつつ、必要
な情報を収集できるように柔軟に対応することが必要である。なお、個別の製品
において必要となる有効性評価計画の評価については、独立行政法人医薬品医
療機器総合機構の対面助言を利用し相談することが勧められる。また、本ガイダ
ンスのほか、国内外のその他の関連ガイドライン等を参考にすることも考慮す
べきである。
3.適用対象
再生医療等製品の条件及び期限付承認制度は、早期の治験データから有効性
が推定され安全性が認められる再生医療等製品について厚生労働大臣が条件及
び期限を付して製造販売承認を与えることができるというものである。細胞、ウ
イルス等を構成体とする再生医療等製品は不均質であることが多く、有効性の
証明には十分な被験者数を組み入れた臨床試験による検証が重要となる一方で、
希少疾患等の少数例の治験で評価せざるを得ないケースが多く、また治験製品
の製造能力、作用機序の革新性、適応患者数、製品の臨床的位置付け等を考慮す
ると、有効性を検証するための臨床データを得るには非常に長い時間がかかり、
治療を待つ患者に製品を届けることが困難になることが想定される。特に、生命
に重大な影響があり、かつ既存の治療法等に十分な効果がない疾患の患者にお
いては、効果が期待される再生医療等製品の開発長期化は致命的な影響を及ぼ
すことも想定される。そのため、治験の結果から、安全性は確認されており有効
性が推定されると認められるものについては、製造販売後に有効性の検証及び
安全性のさらなる評価を行い期限内に改めて申請をすることを前提とした、条
件及び期限付承認制度が創設された。なお、開発企業は条件及び期限付承認を最
終目的とした開発計画を立てるべきではなく、あらかじめ有効性の検証までを
含めて計画すべきである。その過程で実施された探索的試験の結果から、当局が
当該制度の対象となりうると判断したものに適用されるものであることに留意
する必要がある。
したがって、条件及び期限付承認制度設立の背景に立ち返ったとき、下記 1)
~3)のいずれも満たす再生医療等製品が条件及び期限付承認制度の適用となる
ため、予見性を高めたい場合は留意されたい。ただし、新規技術を用いた製品の
場合等、必ずしも下記 1)~3)に当てはまるか明確でない場合が生じることも想
定されるため、条件及び期限付承認制度の適用対象となるか独立行政法人医薬
品医療機器総合機構の対面助言を利用し相談することが勧められる。
3
4
生医療等製品の条件及び期限付承認の判断やその後の有効性評価計画の評価に
あたっては、申請者は個別の製品に固有の特性も十分理解した上で、
「合理性の
ある判断又は評価が達成できない可能性」を最小化することを目指しつつ、必要
な情報を収集できるように柔軟に対応することが必要である。なお、個別の製品
において必要となる有効性評価計画の評価については、独立行政法人医薬品医
療機器総合機構の対面助言を利用し相談することが勧められる。また、本ガイダ
ンスのほか、国内外のその他の関連ガイドライン等を参考にすることも考慮す
べきである。
3.適用対象
再生医療等製品の条件及び期限付承認制度は、早期の治験データから有効性
が推定され安全性が認められる再生医療等製品について厚生労働大臣が条件及
び期限を付して製造販売承認を与えることができるというものである。細胞、ウ
イルス等を構成体とする再生医療等製品は不均質であることが多く、有効性の
証明には十分な被験者数を組み入れた臨床試験による検証が重要となる一方で、
希少疾患等の少数例の治験で評価せざるを得ないケースが多く、また治験製品
の製造能力、作用機序の革新性、適応患者数、製品の臨床的位置付け等を考慮す
ると、有効性を検証するための臨床データを得るには非常に長い時間がかかり、
治療を待つ患者に製品を届けることが困難になることが想定される。特に、生命
に重大な影響があり、かつ既存の治療法等に十分な効果がない疾患の患者にお
いては、効果が期待される再生医療等製品の開発長期化は致命的な影響を及ぼ
すことも想定される。そのため、治験の結果から、安全性は確認されており有効
性が推定されると認められるものについては、製造販売後に有効性の検証及び
安全性のさらなる評価を行い期限内に改めて申請をすることを前提とした、条
件及び期限付承認制度が創設された。なお、開発企業は条件及び期限付承認を最
終目的とした開発計画を立てるべきではなく、あらかじめ有効性の検証までを
含めて計画すべきである。その過程で実施された探索的試験の結果から、当局が
当該制度の対象となりうると判断したものに適用されるものであることに留意
する必要がある。
したがって、条件及び期限付承認制度設立の背景に立ち返ったとき、下記 1)
~3)のいずれも満たす再生医療等製品が条件及び期限付承認制度の適用となる
ため、予見性を高めたい場合は留意されたい。ただし、新規技術を用いた製品の
場合等、必ずしも下記 1)~3)に当てはまるか明確でない場合が生じることも想
定されるため、条件及び期限付承認制度の適用対象となるか独立行政法人医薬
品医療機器総合機構の対面助言を利用し相談することが勧められる。
3
4