よむ、つかう、まなぶ。
総-9参考1 (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_68608.html |
| 出典情報 | 中央社会保険医療協議会 総会(第641回 1/14)《厚生労働省》 |
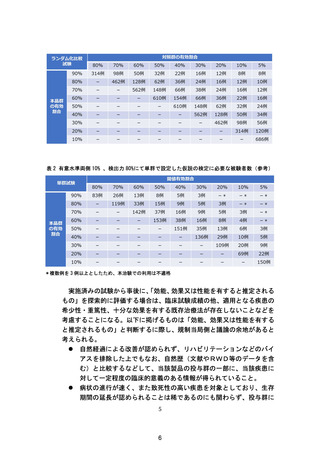
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
が判断している。これまで条件及び期限付承認を得た4品目は、申請データの内
容に伴いケースバイケースの対応がなされているが、内閣府の再生・細胞医療・
遺伝子治療開発協議会において、条件及び期限付承認の予見可能性が確保され
ることが期待されると指摘を受けている3。
2.趣旨
再生医療等製品の条件及び期限付承認では、治験の結果から安全性が確認さ
れており有効性が推定されると認められることが要件の一つである。再生医療
等製品の条件及び期限付承認においては、一連の臨床開発の過程の中で、最終的
に製品が患者にもたらすベネフィットを推定した上で、開発早期の探索的臨床
試験で得られる一定程度の有効性に関する情報と、製造販売後に承認条件に基
づいて実施される評価で得られる有効性及び安全性に関する情報を検討するこ
とが重要である。すなわち、条件及び期限付承認での製造販売は、その後にひか
えている通常の承認審査、再審査へとつづく臨床開発の過程の途上と捉えるこ
とが適当である。したがって、条件及び期限付承認を経る臨床開発では、製造販
売後の通常の製造販売承認審査に向け、製造販売後承認条件評価における有効
性及び安全性の評価について、合理的かつ実施可能性のある計画が製造販売承
認申請時に提示される必要がある4。また、条件及び期限付承認を得た再生医療
等製品の有効性・安全性・品質の持続性を確保するためには、製品の不均質性な
ど、条件及び期限付承認の背景に関する更なる理解並びに品質の再現性を継続
的に向上させる承認取得後の取組みが重要であり、これらについての計画も製
造販売承認申請時に提示されることが望ましい。条件及び期限付承認制度をよ
く理解したうえで、適切な運用が必要とされる。
本ガイダンスは、条件及び期限付承認制度の適用対象となる再生医療等製品
の開発の可能性を高めることを目的に、本制度の適用対象を具体的に例示する
とともに、開発における留意事項のほか、条件及び期限付承認における製造販売
後承認条件評価として実施する使用成績調査若しくは製造販売後臨床試験のデ
ザイン、並びに不均質な再生医療等製品の有効性・安全性・品質の持続性確保の
ために条件及び期限付承認後に実施される活動の計画について、条件及び期限
付承認制度の適用を受けるためにどのような点に留意すべきか等に関する基本
的な考え方を示すものである。
ただし、本ガイダンスは、今後の更なる技術革新や知見の集積等を踏まえ改訂
3
再生・細胞医療・遺伝子治療開発協議会の議論の中間まとめ(令和 3 年 5 月 28 日)
4
再生医療等製品の技術的ガイダンス(平成 28 年医療機器審査管理課事務連絡) 4.6.2 条件
及び期限付承認制度と開発のライフサイクル
2
3
容に伴いケースバイケースの対応がなされているが、内閣府の再生・細胞医療・
遺伝子治療開発協議会において、条件及び期限付承認の予見可能性が確保され
ることが期待されると指摘を受けている3。
2.趣旨
再生医療等製品の条件及び期限付承認では、治験の結果から安全性が確認さ
れており有効性が推定されると認められることが要件の一つである。再生医療
等製品の条件及び期限付承認においては、一連の臨床開発の過程の中で、最終的
に製品が患者にもたらすベネフィットを推定した上で、開発早期の探索的臨床
試験で得られる一定程度の有効性に関する情報と、製造販売後に承認条件に基
づいて実施される評価で得られる有効性及び安全性に関する情報を検討するこ
とが重要である。すなわち、条件及び期限付承認での製造販売は、その後にひか
えている通常の承認審査、再審査へとつづく臨床開発の過程の途上と捉えるこ
とが適当である。したがって、条件及び期限付承認を経る臨床開発では、製造販
売後の通常の製造販売承認審査に向け、製造販売後承認条件評価における有効
性及び安全性の評価について、合理的かつ実施可能性のある計画が製造販売承
認申請時に提示される必要がある4。また、条件及び期限付承認を得た再生医療
等製品の有効性・安全性・品質の持続性を確保するためには、製品の不均質性な
ど、条件及び期限付承認の背景に関する更なる理解並びに品質の再現性を継続
的に向上させる承認取得後の取組みが重要であり、これらについての計画も製
造販売承認申請時に提示されることが望ましい。条件及び期限付承認制度をよ
く理解したうえで、適切な運用が必要とされる。
本ガイダンスは、条件及び期限付承認制度の適用対象となる再生医療等製品
の開発の可能性を高めることを目的に、本制度の適用対象を具体的に例示する
とともに、開発における留意事項のほか、条件及び期限付承認における製造販売
後承認条件評価として実施する使用成績調査若しくは製造販売後臨床試験のデ
ザイン、並びに不均質な再生医療等製品の有効性・安全性・品質の持続性確保の
ために条件及び期限付承認後に実施される活動の計画について、条件及び期限
付承認制度の適用を受けるためにどのような点に留意すべきか等に関する基本
的な考え方を示すものである。
ただし、本ガイダンスは、今後の更なる技術革新や知見の集積等を踏まえ改訂
3
再生・細胞医療・遺伝子治療開発協議会の議論の中間まとめ(令和 3 年 5 月 28 日)
4
再生医療等製品の技術的ガイダンス(平成 28 年医療機器審査管理課事務連絡) 4.6.2 条件
及び期限付承認制度と開発のライフサイクル
2
3